Modelowanie matematyczne rzuca światło na przyczyny agresywnego podtypu białaczki
Naukowcy z Międzynarodowego Instytutu Biologii Molekularnej i Komórkowej w Warszawie (IIMCB), we współpracy z onkologami z Heidelbergu, Kilonii i Drezna, zbadali uwarunkowania genetyczne agresywnej postaci ostrej białaczki szpikowej (AML). Ich praca, opublikowana w czasopiśmie Leukemia (Springer Nature), skupia się na uszkodzeniach genu TP53 i poważnych aberracjach chromosomalnych.
Badania międzynarodowego zespołu koncentrowały się na ciężkiej i stosunkowo mało poznanej postaci białaczki, znanej jako AML z kariotypem złożonym (complex karyotype AML, CK-AML). Mimo iż, CK-AML nie występuje często, jest bardzo groźnym schorzeniem – skuteczne leczenie praktycznie nie istnieje i wielu pacjentów nie przeżywa dłużej niż rok. Projekt badawczy nad CK-AML polegał na połączeniu danych genetycznych z modelowaniem matematycznym, co pozwoliło na wyjaśnienie molekularnych mechanizmów uszkodzeń genu TP53, odpowiadających za ciężki przebieg choroby.
TP53 - gen na straży zdrowia
TP53 jest genem kodującym białko p53, często określane jako „strażnik genomu”. Zatrzymuje ono podział uszkodzonych komórek i uruchamia naprawę DNA lub apoptozę – zaprogramowaną śmierć komórek, która eliminuje komórki z niebezpiecznymi mutacjami. Gdy TP53 ulega uszkodzeniu, mechanizm ten zostaje osłabiony, co pozwala nieprawidłowym komórkom dzielić się w sposób niekontrolowany i zwiększa ryzyko rozwoju nowotworu.
Zaburzenia genu TP53 występują w wielu typach nowotworów, w tym w raku piersi, płuc i jelita grubego, a także w białaczkach. Utrata prawidłowej funkcji p53 sprzyja niestabilności , ułatwiając powstawanie tzw. złożonych kariotypów (zawierających wiele uszkodzonych chromosomów), obserwowanych w najbardziej agresywnych formach AML. Z tego powodu CK-AML z mutacją TP53 uznawana jest za odrębny biologicznie podtyp choroby, posiadający własny, przyspieszony tryb rozwoju.
Ciekawość naukowa napędzana potrzebami pacjentów
Dla pierwszej autorki pracy, Anny Fedenko z Laboratorium Biologii Strukturalnej IIMCB, projekt wpisuje się w naukowe zainteresowanie mechanizmami molekularnymi złożonych nowotworów. Gdy prof. Matthias Bochtler, kierownik Laboratorium Biologii Strukturalnej i autor korespondencyjny publikacji, zaproponował badanie oparte na sekwencjonowaniu mutacji TP53 w kontekście CK-AML, decyzja badaczki o dołączeniu do projektu była natychmiastowa.
- Wiedziałam, że chcę wziąć udział w tym badaniu i doprowadzić je do końca, ponieważ interesuję się medycyną precyzyjną i jej ogromnym potencjałem w przekładaniu odkryć naukowych na bezpośrednie korzyści dla pacjentów – mówi Anna Fedenko.
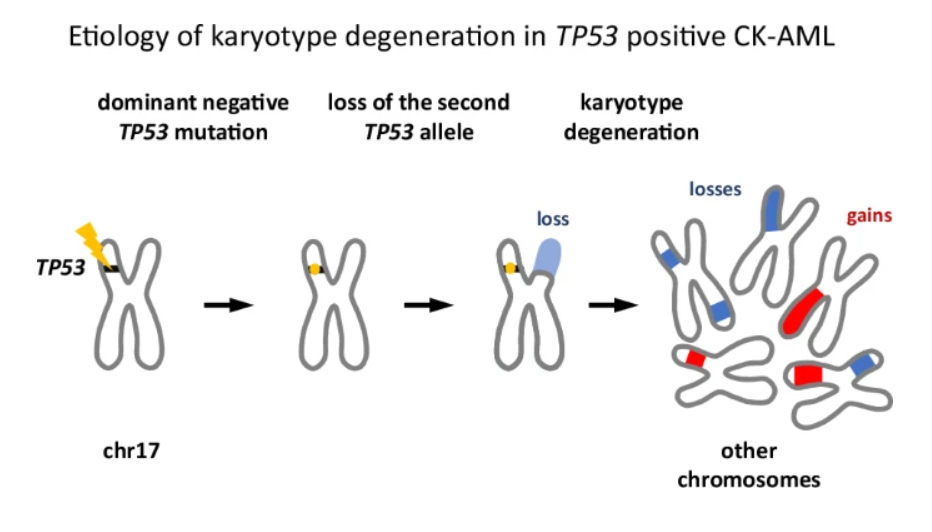 Fig.: Gen TP53, kluczowy strażnik ludzkiego genomu, wymaga dwóch zdrowych kopii, aby prawidłowo funkcjonować. W przypadku ostrej białaczki szpikowej ze złożonym kariotypem CK-AML często dochodzi do utraty obu kopii (alleli) genu TP53, co powoduje poważne uszkodzenie genomu. Nasze badania pokazują częsty przebieg tego uszkodzenia: najpierw dochodzi do mutacji jednej kopii genu TP53, co osłabia jego zdolność do ochrony DNA. Następnie mutacja sprzyja usunięciu drugiej, nadal zdrowej kopii genu TP53. W tym momencie komórka nie ma już sprawnego genu TP53. Bez TP53 genom staje się niestabilny. W rezultacie pojawia się wiele dodatkowych zmian w DNA, takich jak brakujące fragmenty chromosomów, dodatkowe kopie lub nieprawidłowe pękanie i ponowne łączenie chromosomów. Te liczne zmiany razem powodują chaos genomowy, który nazywamy złożonym kariotypem.
Fig.: Gen TP53, kluczowy strażnik ludzkiego genomu, wymaga dwóch zdrowych kopii, aby prawidłowo funkcjonować. W przypadku ostrej białaczki szpikowej ze złożonym kariotypem CK-AML często dochodzi do utraty obu kopii (alleli) genu TP53, co powoduje poważne uszkodzenie genomu. Nasze badania pokazują częsty przebieg tego uszkodzenia: najpierw dochodzi do mutacji jednej kopii genu TP53, co osłabia jego zdolność do ochrony DNA. Następnie mutacja sprzyja usunięciu drugiej, nadal zdrowej kopii genu TP53. W tym momencie komórka nie ma już sprawnego genu TP53. Bez TP53 genom staje się niestabilny. W rezultacie pojawia się wiele dodatkowych zmian w DNA, takich jak brakujące fragmenty chromosomów, dodatkowe kopie lub nieprawidłowe pękanie i ponowne łączenie chromosomów. Te liczne zmiany razem powodują chaos genomowy, który nazywamy złożonym kariotypem.
Strategia łącząca sekwencjonowanie i modelowanie
Praca nad rzadką chorobą wiązała się z ograniczeniami wynikającymi z niewielkiej grupy pacjentów, jednak zastosowana strategia analityczna pozwoliła zespołowi pozyskać znacznie więcej informacji niż początkowo oczekiwano. Próbki szpiku kostnego pobrane od chorych analizowano metodą sekwencjonowania nowej generacji (NGS) w oparciu o infrastrukturę badawczą IN-MOL-CELL Międzynarodowego Instytutu Biologii Molekularnej i Komórkowej w Warszawie oraz GCF Centrum Nowych Technologii, co umożliwiło jednoczesne wykrycie mutacji punktowych oraz aberracji chromosomalnych w ramach jednej analizy.
Dane połączono z prostym modelowaniem matematycznym, które pozwoliło oszacować odsetek komórek niosących określone mutacje TP53 oraz zmiany liczby kopii tego genu (copy-number alterations). Porównując częstości wariantów alleli (VAF) ze zmiennością liczby kopii (CNV), badacze określili kolejność, w której następowały poszczególne zdarzenia genetyczne. Jest to proces, który trudno bezpośrednio zaobserwować u pacjentów.
Białaczka z mutacją TP53 jako odrębna jednostka chorobowa
Kluczowym momentem badań było połączenie wielowarstwowej analizy w spójny obraz.
- Dostrzeżenie, że wszystkie elementy układają się w całość – i że rodzi ona wiele nowych pytań – było jednym z najbardziej satysfakcjonujących etapów tej pracy - wspomina Anna Fedenko.
Badania wpisały się w przekonanie, że ostra białaczka szpikowa charakteryzująca się mutacją TP53 i złożonym kariotypem stanowi odrębny podtyp AML, o unikalnej patofizjologii i charakterystycznej kolejności zaburzeń genetycznych. Odrębna klasyfikacja CK-AML, może poprawić diagnostykę oraz sposób leczenia AML, a także usprawnić ocenę rokowania i zagrożeń dla dotkniętych nią pacjentów. Ponadto pogłębiona analiza sekwencji zdarzeń prowadzących do całkowitej inaktywacji TP53 może pomóc w opracowaniu nowych terapii ukierunkowanych na mechanizmy przywracania funkcji tego niezwykle ważnego genu.
POTENCJALNE ZASTOSOWANIE BADAŃ OPISANYCH W LEUKEMIA:
-
- Hematologia, onkologia kliniczna, genetyka nowotworów – lepsze zrozumienie znaczenia prognostycznego mutacji TP53 oraz częstości ich występowania w szpiku kostnym i krwi
- Diagnostyka – krok w kierunku opracowania testów genetycznych oraz narzędzi bioinformatycznych rekonstruujących sekwencję zaburzeń genetycznych w ewolucji nowotworu
- Bioinformatyka – zastosowanie modelu prognozującego kolejność zdarzeń molekularnych w rozwoju białaczki
- Farmakologia – w szczególności dla zespołów opracowujących terapie celowane przeciwko mutacjom TP53 występującym w najcięższych nowotworach
Potrzeba dalszych badań
Naukowcy z IIMCB podkreślają, że uzyskane przez nich wyniki nie stanowią przełomu w leczeniu ostrej białaczki szpikowej. Zmiany w protokołach diagnostyki i leczenia białaczek wymagają pogłębionych, długoterminowych badań, które pozwolą na potwierdzenie ewolucji CK-AML, jak również badań klinicznych, które ocenią potencjalne skutki terapeutyczne.
- Być może, jeśli nauczymy się ponownie „włączać” TP53, pewnego dnia uda się zapobiec śmiertelnym chorobom lub zatrzymać ich przebieg – jednak wymaga to znacznie głębszych badań” – wyjaśnia Anna Fedenko i dodaje - dla mnie ta praca jest kroplą w wielkim morzu odkryć i tego, co dopiero czeka na odkrycie. Lecz nie byłoby morza bez tych małych kropli – pojedynczych skrawków wiedzy, które się na nie składają. Ten skumulowany wzrost jest istotą badań podstawowych” – podsumowuje pierwsza autorka badania.
The article Etiology of TP53-mutated complex karyotype acute myeloid leukemia in the Leukemia journal (Springer Nature) is available here: https://doi.org/10.1038/s41375-025-02835-9
Projekt został zrealizowany we współpracy z onkologami z Niemieckiego Centrum Badań nad Rakiem (DKFZ) w Heidelbergu, Uniwersytetu w Heidelbergu, Uniwersytetu Medycznego Carl Gustav Carus w Dreźnie, Uniwersyteckiego Szpitala Szlezwik-Holsztyn w Kilonii oraz Uniwersyteckiego Szpitala w Heidelbergu. Autorzy dziękują Core Facilities IIMCB i GCF CeNT – w tym zespołom odpowiedzialnym za przygotowanie bibliotek, sekwencjonowanie i sortowanie komórek – a także pacjentom i ich rodzinom, którzy przekazali próbki do badań.
Finansowanie: Fundacja na rzecz Nauki Polskiej (FNP), Europejski Fundusz Rozwoju Regionalnego UE [POIR.04.04.00-00-5D81/17-00]; Polska Narodowa Agencja Wymiany Akademickiej [NAWA, PPI/APM/2018/1/00034], Narodowe Centrum Nauki [NCN, 2018/30/Q/NZ2/00669], UE NextGenerationEU w ramach Krajowego Planu Odbudowy i Odporności, Unia Europejska (projekt RACE nr 101059801), Europejskie Fundusze na rzecz Inteligentnej Gospodarki 2021-2027 (FENG) (RACE-PRIME, program IRAP FNP) przy wsparciu infrastruktury IIMCB IN-MOL-CELL (RRID:SCR_021630).

