Nowa publikacja i znakomite recenzje! Artykuł autorstwa dr hab. Honoraty Czapińskiej i prof. dr. hab. Matthiasa Bochtlera z Laboratorium Biologii Strukturalnej został opublikowany w prestiżowym Angewandte Chemie, czasopiśmie Niemieckiego Towarzystwa Chemicznego (GDCh), jednego z najlepszych czasopism chemicznych na świecie. Gratulacje dla autorów!
Triady katalityczne należą do najbardziej powszechnych centrów aktywnych enzymów. Tworzą je trzy aminokwasy. Pierwszym z nich jest reszta odpowiedzialna za atak nukleofilowy, rozpoczynający proces katalizy (typowo seryna lub cysteina). Drugim histydyna aktywująca łańcuch boczny nukleofila przez odebranie od niego protonu. Trzeci to zwykle asparaginian, glutaminian lub asparagina stabilizująca histydynę. Triady katalityczne mogą mieć konfigurację Nε lub Nδ w zależności od tego, który z azotów łańcucha bocznego histydyny jest zwrócony w kierunku nukleofila. Obie konfiguracje wydają się równoważne, ale różnią się ze względu na nieznacznie wyższą zasadowość atomu Nε. Powoduje ona, że konfiguracja Nδ, w której proton ten zwrócony jest w kierunku trzeciej reszty o kwaśnym lub amidowym łańcuchu bocznym, jest bardziej stabilna. W konsekwencji, taka konfiguracja przeważa wśród triad niekatalitycznych, wolnych od dodatkowych ograniczeń. W triadach katalitycznych, histydyna musi spełnić swoje zadanie, a co za tym idzie ich konfiguracja jest uzależniona od nukleofila. W przypadku triad cysteinowych, deprotonacja nukleofila jest łatwiejsza i zachodzi przed rozpoczęciem reakcji. Tym samym, wyższa zasadowość azotu skierowanego w jego stronę nie jest kluczowa. W związku z tym, cysteinowe triady katalityczne zachowują się podobnie jak triady niekatalityczne i mają w większości konfigurację Nδ. Dla odróżnienia, w przypadku serynowych triad katalitycznych, deprotonacja jest trudniejsza i możliwa jedynie w trakcie reakcji, pod wpływem dodatkowej aktywującej bliskości substratu. Stąd też, zasadowość azotu histydyny zwróconego w stronę nukleofila ma większe znaczenie. W wyniku tego, wśród serynowych triad katalitycznych (obejmujących triady peptydaz, esteraz, transferaz, oksydoreduktaz i liaz) występuje niemal wyłącznie mniej stabilna, „sfrustrowana” konfiguracja Nε.
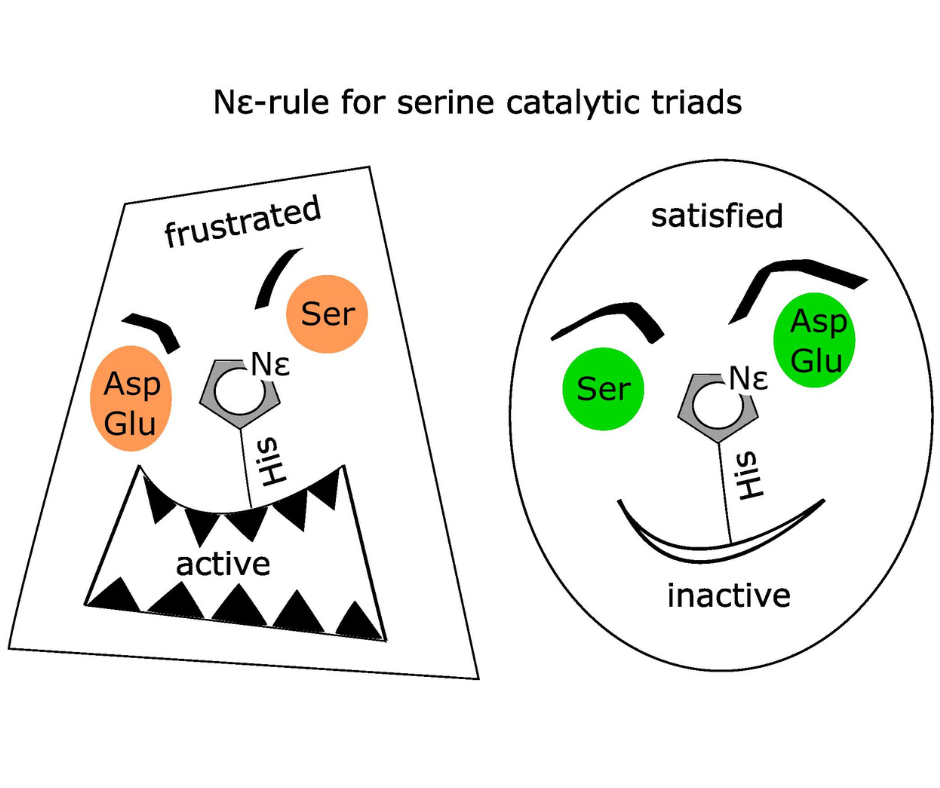
Konfiguracja Nε typową cechą serynowych triad katalitycznych: Triady serynowe występują w dwóch konfiguracjach: z atomem Nε histydyny skierowanym w stronę seryny (po lewej) lub trzeciej reszty triady (po prawej). Pierwsza z nich jest mniej stabilna („sfrustrowana”), ale bardziej wspomaga trudny transfer protonu z reszty seryny w trakcie katalizy. Stąd też, występuje we wszystkich serynowych triadach katalitycznych (oprócz CheB oraz PGM), podczas gdy druga przeważa wśród triad nie-katalitycznych.
