Naukowcy z Laboratorium Struktury Białka - w Nucleic Acids Research.
Struktury kompleksów aneksyny A2 z PS DNA wskazują na dominującą rolę oddziaływań hydrofobowych w wiązaniu tiofosforanów. Naukowcy z Laboratorium Struktury Białka opublikowali w Nucleic Acids Research artykuł opisujący strukturalne spostrzeżenia dotyczące mechanizmu niespecyficznego wiązania tiofosforanowych leków opartych o kwasy nukleinowe z białkami. Praca została wykonana we współpracy z Ionis Pharmaceuticals - wiodącą firmą w dziedzinie leków ukierunkowanych na RNA oraz synchrotronem Diamond.
Szkielet tiofosforanowy (PS) jest najczęściej stosowaną modyfikacją w lekach opartych o kwasy nukleinowe, w tym oligonukleotydach antysensowych (ASO). Modyfikacja ta polega na wymianie jednego z dwóch atomów tlenu w powtarzających się grupach fosforanowych DNA na atom siarki. Kwasy nukleinowe z modyfikacjami PS wykazują ulepszone właściwości, takie jak odporność na degradację przez nukleazy. Jedną z cech charakterystycznych tych związków jest wzmocnione oddziaływanie z białkami komórkowymi. Ta właściwość z jednej strony ułatwia komórkowy wychwyt leków opartych o kwasy nukleinowe i ich zatrzymanie w komórce, z drugiej zaś może przyczyniać się do cytotoksycznych właściwości cząsteczki leku. Co ważne, molekularne mechanizmy oddziaływań pomiędzy kwasami nukleinowymi z modyfikacjami PS a białkami nie zostały w pełni poznane.
Aby lepiej zrozumieć, w jaki sposób PS ASO oddziałują z białkami komórkowymi, Hyjek-Składanowska i wsp. rozwiązali struktury krystalograficzne PS ASO związanego z aneksyną A2 (AnxA2), białkiem pozbawionym kanonicznych domen wiążących DNA, dla którego jednakże sugerowano zaangażowanie w uwalnianie PS ASO z przedziałów endolizosomalnych. W swojej pracy autorzy stwierdzili, że za oddziaływania pomiędzy atomem siarki pochodzącym z grupy PS a powierzchnią białka odpowiadają łańcuchy boczne reszt lizyny i argininy. Oddziaływania te mają głównie charakter hydrofobowy, co sugeruje, że hydrofobowy charakter siarki przyczynia się do wiązania PS ASO do białek komórkowych. Co ważne, wysoka jakość kryształów pozwoliła na wykorzystanie unikalnego układu eksperymentalnego na synchrotronie Diamond do przeprowadzenia eksperymentów dyfrakcji promieniowania X o dużej długości fali. Eksperymenty te doprowadziły do precyzyjnego zlokalizowania atomów siarki w strukturze i pozwoliły autorom ustalić, które z atomów tlenu są zastąpione atomami siarki w DNA związanym z białkiem. Co ciekawe, wyniki te pokazały, że preferencja stereoizomeru przy danej grupie tiofosforanowej w oligonukleotydzie DNA jest zdeterminowana przez hydrofobowe środowisko wokół wiązania PS pochodzące nie tylko od białka, ale także od sąsiednich elementów strukturalnych w obrębie leku DNA, takich jak grupy metylowe na zasadach azotowych cytozyny. Badania te będą bardzo pomocne przy projektowaniu nowej generacji leków opartych na DNA, które będą stabilniejsze i mniej toksyczne.
Malwina Hyjek-Składanowska, Brooke A Anderson, Vitaliy Mykhaylyk, Christian Orr, Armin Wagner, Jarosław T Poznański, Krzysztof Skowronek, Punit Seth, Marcin Nowotny, Structures of annexin A2-PS DNA complexes show dominance of hydrophobic interactions in phosphorothioate binding, Nucleic Acids Research, 2022;, gkac774, https://doi.org/10.1093/nar/gkac774
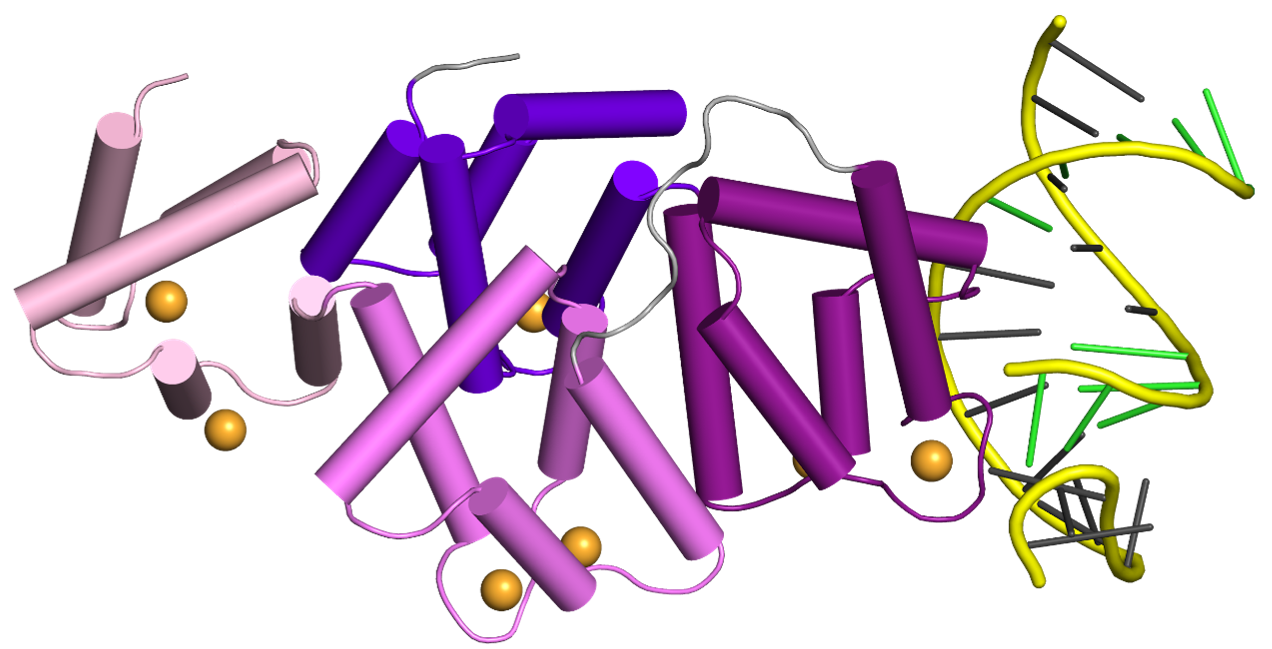
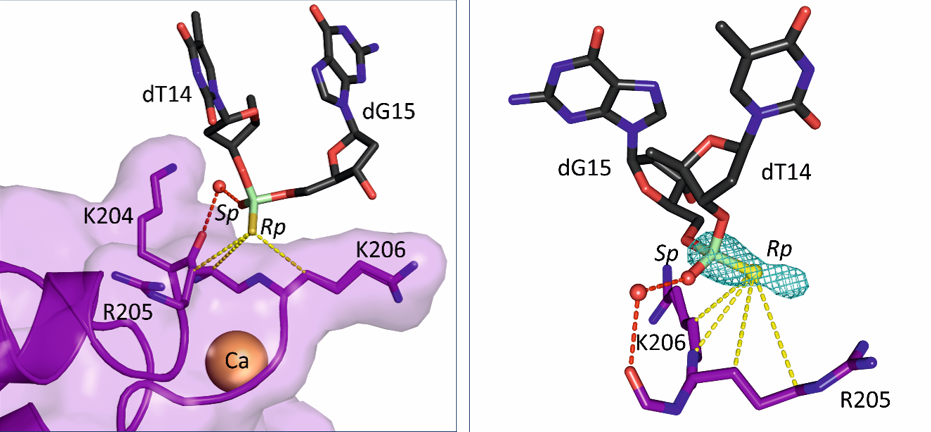
Struktura krystalograficzna AnxA2 w kompleksie z dupleksem PS ASO. Białko jest pokazane na fioletowo, a lek oparty o DNA — na żółto. Środkowy panel pokazuje zbliżenie na powierzchnię wiążącą grupę tiofosforanową w AnxA2. Prawy panel pokazuje różnicową mapę anomalną Fouriera obliczoną na podstawie danych dyfrakcji rentgenowskiej o dużej długości fali (λ = 2,7552 Å, zielona siatka). Pozycja zmodyfikowanego siarką DNA związanego przez białko jest zależna od oddziaływań hydrofobowych z otaczającymi aminokwasami.
