Naukowcy z Laboratorium Struktury Białka Międzynarodowego Instytutu Biologii Molekularnej i Komórkowej w Warszawie wyjaśnili mechanizm działania kluczowego kompleksu białkowego w bakteryjnej rekombinacji homologicznej.
Rekombinacja homologiczna jest jedną z podstawowych ścieżek naprawy uszkodzonej informacji genetycznej. Proces ten polega ona na wytworzeniu jednoniciowej cząsteczki DNA w miejscu uszkodzenia. Następnie, fragment ten jest wykorzystany do poszukiwania matrycy w oparciu o homologię. W przypadku bakterii w jedną ze ścieżek naprawy DNA opartych na rekombinacji homologicznej zaangażowane są białka RecF, RecO i RecR. Białka te wiążą się na styku jednoniciowego (ss) i dwuniciowego (ds) DNA, a następnie ułatwiają wymianę białka SSB (pokrywa ono początkowo ssDNA) na białko RecA, które promuje poszukiwanie sekwencji homologicznej. Dotychczas molekularny mechanizm działania białek RecFOR w tym szlaku był w dużej mierze nieznany. Aby wyjaśnić mechanizm współpracy tych białek w rozpoznawaniu połączeń ss-dsDNA, Shivlee Nirwal i współpracownicy z Laboratorium Struktury Białka, pod kierownictwem prof. Marcina Nowotnego, zbadali struktury kompleksów RecF-DNA i RecFOR-DNA oraz ich subkompleksów. Użyli do tego najnowocześniejszych technik kriomikroskopii elektronowej, korzystając z mikroskopów w Narodowym Centrum Promieniowania Synchrotronowego SOLARIS.
Struktury subkompleksów RecF-DNA i RecFR-DNA pokazują, jak dimer białka RecF wykorzystuje helikalne wypustki do wiązania dwuniciowej cząsteczki DNA. Struktura subkompleksu RecFR-DNA pokazuje ponadto sposób, w jaki jedna cząsteczka białka RecF oddziałuje z dwoma różnymi regionami pierścienia zbudowanego z czterech kopii białka RecR, co stabilizuje ten pierścień na cząsteczce DNA. Rekonstrukcje o niższej rozdzielczości subkompleksu RecR-RecO oraz całego układu RecFOR-DNA wyjaśniają, w jaki sposób białko RecO jest pozycjonowane, aby oddziaływać z ssDNA i białkiem SSB, co blokuje kompleks na styku ssDNA-dsDNA. Powyższe modele zostały zweryfikowane poprzez szereg eksperymentów biochemicznych i biofizycznych. Podsumowując, uzyskane wyniki integrują i wyjaśniają opublikowane dane biochemiczne dostępnych dla systemu RecFOR i budują podstawę do pełnego zrozumienia mechanizmu ścieżki rekombinacji homologicznej RecFOR.
Link do publikacji: https://www.nature.com/articles/s41594-023-00967-z
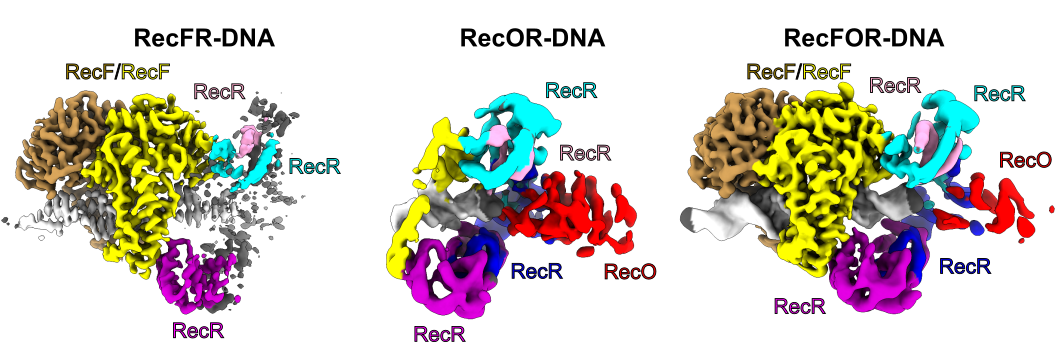
Fig: Rekonstrukcje kompleksu RecFOR-DNA oraz subkompleksów RecFR-DNA i RecOR-DNA wykonane przy użyciu kriomikroskopii elektronowej.
