News
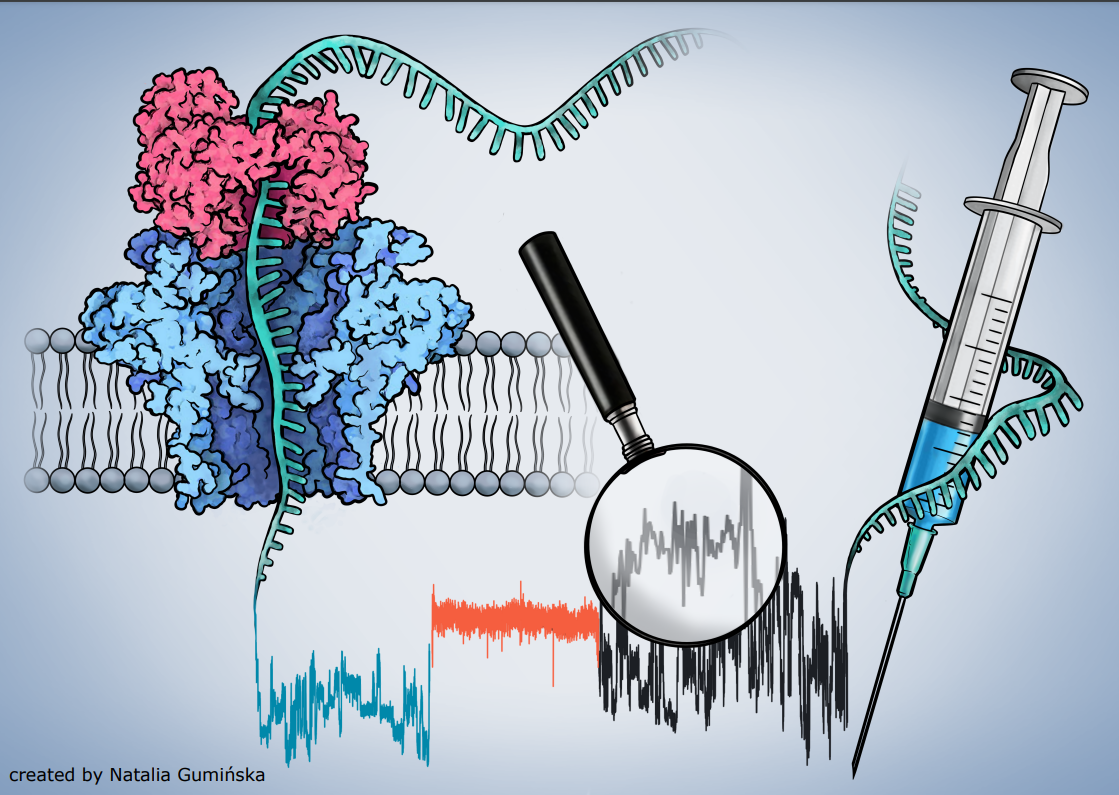
Prof. Andrzej Dziembowski z Międzynarodowego Instytutu Biologii Molekularnej i Komórkowej w Warszawie otrzymał ERC Advanced Grant. Po raz pierwszy grant taki otrzymuje naukowiec pracujący w Polsce w dziedzinie nauk o życiu. To prestiżowe wyróżnienie przyznawane jest przez Europejską Radę ds. Badań Naukowych, aby umożliwić prowadzenie przełomowych badań przez wybitnych naukowców. Celem projektu prof. Dziembowskiego jest poznanie mechanizmów procesowania mRNAw komórkach i w całym organizmie, co umożliwi opracowywanie nowej generacji terapii opartych na mRNA. Projekt o akronimie ViveRNA realizowany będzie przez 5 lat, a jego budżet wynosi blisko 2,5 mln euro.
Szczepionki mRNA stały się przełomem w walce z pandemią COVID-19, torując drogę terapiom opartym na mRNA i umożliwiając ich szersze zastosowanie w medycynie. Jednak procesy metabolizmu mRNA na poziomie organizmu nadal nie są w pełni poznane, co ogranicza możliwości udoskonalania szczepionek i terapii opartych na RNA. Z tego właśnie powodu, prof. Andrzej Dziembowski i jego zespół będą szczegółowo badać możliwości zwiększenia stabilności mRNA, co powinno pozwolić na optymalizację zastosowań mRNA w terapiach medycznych.
- Na stabilność cząsteczek mRNA wpływa długość ogona poli(A), co z kolei przekłada się na sposób i skuteczność działania terapii. Wstępne dane zebrane przez mój zespół wykazały, że zmienność w sposobie przetwarzania ogonów poli(A) w różnych komórkach jest znacznie większa niż wcześniej sądzono – wyjaśnia prof. Andrzej Dziembowski. – Jednym z celów projektu ViveRNA jest zwiększenie dokładności metody stosowanej do określania właściwości mRNA, w tym długości ogonów poli(A). W naszych pracach wykorzystamy m. in. hodowle komórek pierwotnych i metody z zakresu biologii syntetycznej. Wierzę, że te badania ułatwią projektowanie terapii mRNA następnej generacji – dodaje prof. Andrzej Dziembowski.
Prestiżowe granty ERC wspierają przełomowe badania realizowane w wielu dziedzinach, od fizyki i medycyny po nauki społeczne i humanistyczne. Projekty ERC przyznawane są zgodnie z zasadą „wysokie ryzyko – wysoki zysk” (High risk – high gain), a jedynym kryterium oceny pomysłów jest ich doskonałość naukowa. W tym roku Europejska Rada ds. Badań Naukowych, spośród zgłoszonych 1650 wniosków, przyznała 218 projektów w kategorii Advanced Grants o łącznej wartości 544 mln euro. Przyjmuje się, że oprócz wzmocnienia jakości badań prowadzonych w całej Europie - przyznane dotacje przyczynią się do stworzenia nowych miejsc pracy dla stypendystów podoktorskich, doktorantów i innych pracowników instytucji, w której realizowany będzie nagrodzony projekt.
- Uzyskanie ERC Advanced Grant to wielki sukces na drodze kariery każdego naukowca. Serdecznie gratuluję naszemu laureatowi oraz jego zespołowi badawczemu. Mocno wierzę
w sukces planowanych prac, zwłaszcza że badania dotyczące biologii RNA to obecnie jeden
z najbardziej obiecujących i aktywnie rozwijanych kierunków w naukach biologicznych,
o wielkim potencjale aplikacyjnym w medycynie. Cieszę się również dlatego, że jest to już kolejny grant ERC przyznany dla projektu realizowanego w naszym Instytucie, choć poprzednie (ERC Starting Grants) były kierowane przez naukowców na wcześniejszych etapach kariery. To budujące, że eksperci powoływani przez ERC z międzynarodowego środowiska naukowego doceniają znaczenie i wartość badań, które są realizowane w naszym Instytucie – mówi prof. Marta Miączyńska, Dyrektor Międzynarodowego Instytutu Biologii Molekularnej i Komórkowej w Warszawie.
Europejska Rada ds. Badań Naukowych (ERC) została utworzona w 2007 roku przez Komisję Europejską. Jest niezależną agendą Unii Europejskiej finansującą najwyższej jakości badania prowadzone na terenie UE.
Prof. Andrzej Dziembowski jest kierownikiem Laboratorium Biologii RNA - Grupa ERA Chairs w Międzynarodowym Instytucie Biologii Molekularnej i Komórkowej w Warszawie. Współpracuje również z Uniwersytetem Warszawskim.
Tytuł wyróżnionego projektu : Principles of endogenous and therapeutic mRNA turnover in vivo (ViveRNA).
Główni boheterowie to enzymy systemu ubikwityna-proteasom. Miejsce akcji: organizm ludzki. Cel: wcielenie się w białko UPS - ligazę E3 i wyłapanie na czas substratów celem ich ubikwitynacji. Brzmi tajemniczo? Z prawdziwą przyjemnością informujemy, że rozpoczęły się przygotowania do realizacji nowego przedsięwzięcia edukacyjnego MIBMiK dla młodzieży szkolnej, finansowanego w ramach grantu Ministerstwa Edukacji i Nauki. Grant realizowany jest pod kierownictwem dra hab. Wojciecha Pokrzywy, Kierownika Laboratorium Metabolizmu Białek, koordynatorem projektu edukacyjnego jest Natalia Szulc, doktorantka i stypendystka Fulbright Junior Research Award.
Celem projektu jest stworzenie edukacyjnej gry komputerowej, która w przystępny sposób wytłumaczy mechanizm działania nowoczesnych leków przeciwnowotworowych typu PROTAC. Bohaterami gry będą enzymy systemu ubikwityna-proteasom (UPS) oraz ich substraty. Celem gracza będzie wcielenie się w białko UPS - ligazę E3 i wyłapanie na czas swoich substratów celem ich ubikwitynacji i skierowania do degradacji zależnej od proteasomu 26S. Przykładowo, dzięki power-up'owi – lekowi typu PROTAC – ligaza E3 będzie mogła ubikwitynować białka, które do tej pory nie były jej substratami – np. onkoproteiny.
Każdy etap działania podejmowanego przez gracza, poprzedzony będzie krótką instrukcją, a następnie po zakończeniu każdego z etapów działania – wyświetlony zostanie opis biologicznego mechanizmu, który nastąpił w rezultacie podjętych działań. Gra będzie miała część encyklopedyczną, zawierającą szczegółowe informacje nt. każdego poruszonego w niej zagadnienia oraz bohatera. Po ukończeniu gry, gracz będzie miał możliwość sprawdzenia swojej wiedzy w quizie. Gra będzie dostępna po polsku i angielsku, a jej odbiorcami będą uczniowie szkół ponadpodstawowych w Polsce. Założeniem gry jest przybliżenie mechanizmów działania nowoczesnych leków przeciwnowotworowych oraz utrwalanie zaufania do medycyny i nauki. Gra ma powstać do końca lipca 2024 roku.
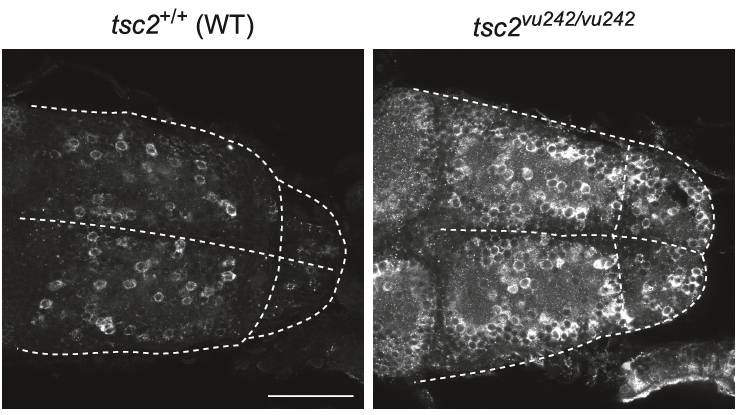
Padaczka jest jednym z najczęstszych zaburzeń neurologicznych, dotykającym ludzi na całym świecie. Wg szacunków WHO choruje na nią ok. 60 mln ludzi. W Polsce choroba ta dotyka ok. 1% całej populacji. Pomimo znacznego postępu w badaniach nad padaczką w ciągu ostatnich kilkudziesięciu lat, nadal jest ona chorobą, która często pozostaje niezdiagnozowana lub niewłaściwie leczona. Dzieje się tak dlatego, że nawet w przypadku chorób o znanym podłożu, wiele pytań pozostaje nadal bez odpowiedzi, bowiem trudno jest uchwycić wszystkie aspekty pozwalające na opracowanie skutecznej terapii. W badaniach nad tym schorzeniem wielki wkład ma zastosowanie modeli zwierzęcych, takich jak Danio pręgowany.
Miło nam poinformować, że Justyna Zmorzyńska z Pracowni Neurologii Molekularnej i Komórkowej MIBMiK została zaproszona do wspólnego projektu stworzenia zasobu edukacyjnego Handbook of animal models in neurological disorder, pod redakcją Colina R. Martina, Vinooda B. Patela i Victora R. Preedy (Elsevier, 2023). Olga Doszyń, Tomasz Dulski i Justyna Zmorzyńska przygotowali rozdział zatytułowany „The zebrafish model of Tuberous sclerosis complex to study epilepsy” (“Model stwardnienia guzowatego w Danio pręgowanym do badań padaczki”), w którym opisują specyficzne metodologie i koncepcje badania padaczki u larw danio pręgowanego w sposób wysokoprzepustowy i klinicznie istotny. W tym rozdziale autorzy podają szczegółowe informacje na temat hodowli i genotypowania modelu zwierzęcego, sposobu odpowiedniego pomiaru aktywności mózgu i zachowań podobnych do napadów padaczkowych, sposobu analizowania epileptogenezy oraz technologii, które należy zastosować do badania patomechanizmów molekularnych leżących u podstaw padaczki.
Publikacja dostępna poprzez serwis Research Gate.
O Doszyn, T Dulski, J Zmorzynska. "The zebrafish model of Tuberous Sclerosis Complex to study epilepsy" in the Handbook of Animal Models in Neurological Disease edited by Colin Martin, Vinood B Patel and Victor R Preedy, Elsevier, 2023.
Dr Aleksandra Kołodziejczyk, kierowniczka Laboratorium Genomiki Komórkowej w Międzynarodowym Instytucie Biologii Molekularnej i Komórkowej w Warszawie, została laureatką programu Polskie Powroty Narodowej Agencji Wymiany Akademickiej (NAWA). Otrzymany grant dr Kołodziejczyk przeznaczy na utworzenie i organizację nowej grup badawczej, oraz, dzięki komponentowi badawczemu z NCN, na rozpoczęcie prac badawczych w MIBMiK. Gratulujemy!
O projekcie
Mikroorganizmy w jelitach, zwane mikrobiomem, wpływają na fizjologię poprzez wytwarzane przez nie metabolity. Wątroba jest pierwszym narządem, do którego docierają składniki odżywcze i inne cząsteczki z jelita, co czyni ją szczególnie narażoną na metabolity produkowane przez mikrobiom. Równowaga między mikrobiomem, a funkcjami jelit i wątroby ma kluczowe znaczenie dla zdrowia przewodu pokarmowego. Celem dr Kołodziejczyk w tym projekcie jest opisanie roli jelit w kontekście marskości wątroby i odkrycie mechanizmów leżących u jej podstaw.
O programie NAWA Polskie Powroty
Polskie Powroty to program umożliwiający wyróżniającym się polskim naukowcom powrót do kraju i podjęcie przez nich zatrudnienia w polskich uczelniach, instytutach naukowych lub instytutach badawczych.
W dniach 28 lutego i 1 marca 2023 roku w Międzynarodowym Instytucie Biologii Molekularnej i Komórkowej w Warszawie odbyło się szkolenie z zakresu etyki i rzetelności w badaniach naukowych. Szkolenie prowadziła Prof. Ana Borovečki, dyrektor Katedry Medycyny Społecznej i Organizacji Opieki Zdrowotnej w Szkole Zdrowia Publicznego na Uniwersytecie w Zagrzebiu (Chorwacja).
W dniu 28 lutego 2023 r. roku nasi naukowcy wzięli udział w sesji wykładowej dotyczącej etycznych aspektów w badaniach naukowych. Sesja obejmowała między innymi następujące tematy:
- rodzaje uchybień w badaniach naukowych,
- rzetelność prac badawczych,
- wymagania dotyczące autorstwa,
- dobre praktyki dla doktorantów i ich opiekunów.
Sesja była bardzo inspirująca i zainteresowała zarówno młodych, jak i bardziej doświadczonych badaczy. W szczególności, uczestnicy z dużym zaangażowaniem podeszli do interaktywnego instruktażu on-line.
W dniu 1 marca 2023 r. doktoranci z MIBMiK uczestniczyli w dwóch warsztatach poświęconych rzetelności badań. Prof. Borovečki omówiła i podała przykłady europejskich wytycznych dotyczących etyki w badaniach biomedycznych. Interesujące było porównanie, jak różni się podejście do kwestii etycznych w różnych częściach świata. W czasie warsztatów studenci mieli okazję do omówienia kwestii etycznych związanych z ich własnymi projektami.
Szkolenie było wspierane przez projekt MOSaIC, który otrzymał dofinansowanie z programu Unii Europejskiej Horyzont 2020 w zakresie badań i innowacji na podstawie umowy nr 810425.
https://www.iimcb.gov.pl/pl/biuro-prasowe/aktualnosci?start=90#sigProIda57ccd9ed5
Z radością informujemy, że dr Ewelina Małecka-Grajek, Kierownik Laboratorium Biofizyki Pojedynczych Cząsteczek otrzymała finansowanie na projekt badawczy ramach konkursu SONATA BIS 12! Tytuł tego projektu brzmi: „Dynamika kompleksów degradujących RNA u bakterii” a jego finansowanie opiewa na kwotę pond 3 mln zł! Serdecznie gratulujemy! Poniżej prezentujemy opis zwycięskiego projektu.
Wszystkie procesy biologiczne zaczynając od bakterii walczących z wirusami po rozwój serca u człowieka są kontrolowane przez zmiany w ekspresji materiału genetycznego i dynamicznych oddziaływań między cząsteczkami białek i RNA. Wiemy już dużo na temat tego jak te białka wyglądają strukturalnie, jakie elementy RNA rozpoznają oraz jaki wpływa na komórkę mają takie oddziaływania lub ich brak. W ostatnich latach coraz więcej nacisku kładzie się na poznawanie mechanizmów molekularnych rządzących procesami biologicznymi. Dzięki takim badaniom możemy zrozumieć, jak mechanizmy ewoluują, ale również możemy lepiej nimi manipulować np. w rozwoju szczepionek.
Celem tego projektu jest badanie mechanizmów molekularnych rządzących komunikacją między poszczególnymi procesami takimi jak wyciszaniem RNA, degradacją RNA i translacją u bakterii. Po-transkrypcyjna regulacja genów odpowiada za reakcję bakterii na stres np. przestawienie metabolizmu na dostępne składniki odżywcze czy dostosowanie się do warunków gospodarza w przypadku patogennych szczepów. Ta regulacja jest umożliwiana przez małe RNA (sRNA) oddziałujące z informacyjnym RNA (mRNA) na zasadzie komplementarności. W parowaniu między sRNA i mRNA uczestniczy białko opiekuńcze Hfq. Związanie mRNA przez sRNA często prowadzi do degradacji obu cząsteczek, a więc obniża ekspresję docelowego mRNA. Z kolei za degradację większości RNA bakteryjnych, także tych sparowanych przez Hfq, odpowiada kompleks białkowy zwany degradosomem zawierający enzym katalizujący cięcie RNA: rybonuklazę E (RNazę E). Co ciekawe, sRNA występują w komórkach w kompleksach z Hfq, ale również Hfq i degradosomem. Nie wiadomo jakie różnice funkcjonalne dzielą te kompleksy. W skład degradosomu często wchodzi też helikaza RhlB rozplatająca ustrukturyzowane RNA, więc stawiamy hipotezę, że obecność degradosomu umożliwia dostęp sRNA do wcześniej niedostępnych miejsc w docelowych mRNA. Ponadto nie wiadomo czy utworzenie stabilnego kompleksu degradującego mRNA zależy od kolejności dołączania poszczególnych komponentów. Wcześniejsze badania wykazały, że większość, lecz nie wszystkie sRNA jest degradowana łącznie z docelowym mRNA, co doprowadziłoby również do wyciszenia regulatora. Nie jest jednak wiadomo jakie czynniki decydują o degradacji sRNA lub czy Hfq jest obecne w tym procesie. Jeśli tak, jest możliwe, że krótkie fragmenty pozostałe po degradacji RNA pozostają związane do Hfq wpływając na dalsze losy docelowych mRNA. Planujemy odtworzyć katalitycznie aktywny degradosom posiadający również zdolność do oddziaływania z białkami. Z wykorzystaniem fluorescencyjnie znakowanych komponentów, będziemy w stanie śledzić składanie kompleksów równolegle z katalizą RNA.
Dodatkowym skomplikowaniem w koordynacji tych procesów jest to, że RNA podlega ciągłej translacji. Wiadomo, że sRNA często celują w obszar wiązania rybosomu na mRNA, jednak nie jest jasne, czy dochodzi do bezpośredniej konkurencji między rybosomem a kompleksem sRNA-Hfq. Ponadto, degradosomy przeprowadzające cięcie w regionach kodujących mRNA muszą bezpośrednio koordynować pracę z rybosomami. Chcemy zwizualizować jak dynamiczne są te procesy. Badania przeprowadzone w ramach tego projektu dadzą wgląd w komunikację między kluczowymi procesami komórkowymi zaangażowanymi w ekspresję informacji genetycznej. Poznamy dynamikę tych mechanizmów w skali milisekund, a więc w realnej rozdzielczości czasowej w jakiej procesy te zachodzą w komórce. Poprzez monitorowanie pojedynczych cząsteczek otrzymamy także wgląd w heterogenność tych procesów. Te wszystkie informacje będą cenne w zaprojektowaniu sztucznych regulatorów ekspresji genów i symulowaniu ich efektów.
Z radością informujemy, że zespół prof. dra. hab. Matthiasa Bochtlera otrzymał Nagrodę Ministra Edukacji i Nauki za znaczące osiągnięcia w zakresie działalności naukowej. Dotyczą one zaawansowanych badań mechanizmów metylacji i demetylacji DNA odpowiedzialnych za stan epigenetyczny genomów. Wyniki tych badań przyczyniły się do zrozumienia mechanizmów regulujących ekspresję genów i zostały opublikowane w cyklu sześciu artykułów naukowych, m.in. w czasopiśmie Nucleic Acids Research. Nagroda została przyznana na Gali Nauki Polskiej, która odbyła się w niedzielę, 19 lutego br w Toruniu. Serdecznie gratulujemy!
Zespół pod kierunkiem prof. Matthiasa Bochtlera zajmuje się wyjaśnieniem mechanizmów wprowadzania, odczytu, usuwania, a przede wszystkim funkcji modyfikacji DNA. Metylacja DNA jest ewolucyjnie wczesnym zjawiskiem, dzięki czemu do badań można wykorzystać również proste modele prokariotyczne. Wykorzystanie systemów bakteryjnych umożliwia znalezienie i charakterystykę enzymów, które są lub mogą być używane jako narzędzia w badaniach metylacji DNA w organizmach wyższych. Prof. Bochtler wykorzystuje w badaniach biochemicznych szeroki repertuar metod od biologii strukturalnej prokariotycznych systemów modelowych, poprzez analizę chemiczną i biofizyczną, kończąc na analizie w komórkach oraz na poziomie bioinformatycznym u zwierząt. Długotrwała współpraca zespołu prof. Bochtlera z firmą biotechnologiczną NEB – kluczowym dostawcą endonukleaz restrykcyjnych stosowanych w inżynierii genetycznej – wskazuje na wysoki potencjał aplikacyjny prowadzonych badań, w tym proponowanych nowych narzędzi molekularnych. Osiągnięcia zespołu prof. Bochtlera mają nowatorski charakter i wyróżniają się bardzo szerokim podejściem do biologii strukturalnej, przyczyniając się do rozwoju tej dyscypliny.
W skład nagrodzonego zespołu wchodzą:
- prof. dr hab. Matthias Bochtler,
- dr hab. Honorata Czapińska,
- dr Humberto Fernandes,
- dr Henryk J. Korza,
- dr Monika Kowalska,
- dr Anton Slyvka,
- mgr Igor Helbrecht,
- mgr Marlena Kisiała,
- mgr Katarzyna Krakowska,
- mgr Michał Pastor
Więcej o wydarzeniu: https://www.gov.pl/web/edukacja-i-nauka/gala-nauki-polskiej



Dr Urszula Białek-Wyrzykowska, Zastępca Dyrektora ds. Rozwoju MIBMiK wzięła udział w konferencji pt. „Doskonałość naukowa nie ma płci”, zorganizowanej przez Akademię Młodych Uczonych PAN na Wydziale Nauk Politycznych i Dziennikarstwa Uniwersytetu im. Adama Mickiewicza w Poznaniu. Wystąpienie zatytułowane „Doskonałość naukowa nie ma płci – ustrukturyzowany długoletni program wyrównywania szans płci poprzez zmiany w warunkach i kulturze pracy” dotyczyło działań podejmowanych przez MIBMiK w tym obszarze. Dr Białek-Wyrzykowska przedstawiła również rekomendacje i przykłady dobrych praktyk wdrażanych w tym zakresie przez konsorcjum europejskich instytutów badawczych EU-LIFE.
Problem nierówności płci w różnych aspektach i obszarach nauki, w tym problem ukrytych uprzedzeń, prowadzących do dysproporcji pomiędzy kobietami i mężczyznami w nauce – to kwestia, która od wielu lat stanowi wyzwanie nie tylko w środowisku naukowym. Badania i raporty z analiz dotyczące tej kwestii, opublikowane m.in. przez Narodowe Centrum Nauki, Fundację na rzecz Nauki Polskiej oraz Fundację L’Oreal – wskazują jednoznacznie na potrzebę wyrównywania dysproporcji między przedstawicielami obu płci na poszczególnych szczeblach i etapach kariery naukowej.
Konferencja zorganizowana przez Akademię Młodych Uczonych PAN stanowiła doskonałą okazję do rozpoczęcia dialogu pomiędzy jednostkami naukowo-badawczymi oraz do wypracowania realnych działań służących przeciwdziałaniu odpływowi ludzi nauki z wielu obszarów badawczych. Wydarzenie to było jest skierowane do władz jednostek naukowo-badawczych, przedstawicieli Ministerstwa Edukacji i Nauki, instytucji finansujących naukę w Polsce oraz organizacji zajmujących się promowaniem nauki i badań naukowych w Polsce.
Konferencja pt. „Doskonałość naukowa nie ma płci” odbyła się 10 lutego br. Jej współorganizatorami byli: Narodowe Centrum Nauki, Centrum Badań nad Partycypacją Kobiet w Przestrzeni Publicznej Uniwersytetu im. Adama Mickiewicza w Poznaniu oraz Biuro Promocji Nauki “PolSCA” Polskiej Akademii Nauk w Brukseli.
Udział przedstawicieli MIBMiK w konferencji został sfinansowany w ramach projektu MOSaIC 

Więcej na ten temat na stronie wydarzenia: https://amu.pan.pl/dnnmp/
https://www.iimcb.gov.pl/pl/biuro-prasowe/aktualnosci?start=90#sigProIdd0a3e52506
Starzenie się organizmu to fascynujący proces biologiczny, podczas którego następuje szereg zmian w przebiegu czynności życiowych komórek oraz całego organizmu. Proces ten może wpływać na obniżenie odporności organizmu oraz zmniejszenie jego umiejętności adaptacyjnych do otaczających warunków. Czy zastanawialiście się kiedyś jak starzenie wpływa na zdolność regulowania poziomów żelaza w naszym organizmie? Czy prosta zmiana diety może poprawić wydajność obrotu żelaza u starzejących się osób? Na te pytania odpowiedzieli Patryk Ślusarczyk i Pratik Mandal oraz współpracownicy pod kierownictwem dr Katarzyny Mleczko-Saneckiej (Laboratorium Homeostazy Żelaza) oraz dr hab. Wojciecha Pokrzywy (Laboratorium Metabolizmu Białek) w najnowszym artykule czasopisma eLife.
Wraz z wiekiem nasze organizmy tracą zdolność do prawidłowej regulacji poziomów żelaza, choć mechanizmy tych zmian nie były dotąd do końca znane. Badanie naukowców z Laboratorium Homeostazy Żelaza i Laboratorium Metabolizmu Białek wykazało, że starzejąc się, makrofagi czerwonej miazgi śledziony (RPM), czyli komórki, które usuwają wadliwe czerwone krwinki, ulegają upośledzeniu i ubumierają. Prowadzi to do powstawania złogów białkowych bogatych w żelazo i hem, oraz do gromadzenia się starych i zużytych czerwonych krwinek w śledzionie. Badanie z użyciem organizmów modelowych – w tym przypadku myszy - wykazało również, że kiedy były one karmione dietą z obniżoną zawartością żelaza, makrofagi RPM były w lepszej kondycji i zdolność organizmu do ‘recyklingu żelaza’ poprawiła się.
Odkrycie to sugeruje, że redukcja żelaza w diecie może być potencjalną strategią utrzymania prawidłowej homeostazy żelaza podczas starzenia. Dostarcza również nowych informacji na temat zależności między starzeniem a homeostazą żelaza i może stanowić podstawę do przyszłych badań dotyczących poprawy zdrowia w populacji starszych osób.
Cały artykuł dostępny pod linkiem: https://elifesciences.org/articles/79196











