Badania naukowe z wykorzystaniem zwierząt laboratoryjnych w MIBMiK
Udział poszczególnych zwierząt w badaniach naukowych prowadzonych przez MIBMiK:
| 2018-2024 | |
| Myszy | 12 314 (56%) |
| Danio pręgowany | 4 043 (18%) |
| Szczury | 5 707 (26%) |
Najczęstsze procedury z wykorzystaniem zwierząt
1. Pozyskanie tkanek – zwierzęta nie są poddawane żadnym procedurom za życia. Są uśmiercane w celu izolacji tkanek. Wyizolowane tkanki są następnie wykorzystywane przykładowo w celu wyprowadzenia linii komórkowych lub badań molekularnych.
2. Doświadczenia z wykorzystaniem zwierząt, najczęstsze procedury:
a) Stymulacja hormonalna – podanie dwóch zastrzyków zawierających hormony, w celu pobudzenia owulacji. Jest to procedura analogiczna do przygotowania kobiet do pobrania komórek jajowych przy procedurze in vitro (lecz liczba podanych zastrzyków jest dużo mniejsza). Procedura pozwala nam na uzyskanie dużej liczby zarodków, które następnie mogą być modyfikowane genetycznie.
b) Wazektomia – zabieg chirurgiczny przeprowadzany w pełnym znieczuleniu ogólnym i ochroną przeciwbólową śród- i pooperacyjną. Wazektomia służy uzyskaniu samców niepłodnych – kryją one samice, które mają przyjąć zarodki poprzez transfer zarodków. Transfer zarodków bez wcześniejszego przygotowania samic poprzez kojarzenie z bezpłodnymi samcami (nieprodukującymi spermy, lecz aktywnymi seksualnie) jest nieskuteczny.
c) Transfer zarodków – zabieg chirurgiczny polegający na przeniesieniu zarodków do jajowodów samic-biorczyń. Operacja jest przeprowadzana z użyciem mikroskopu, w pełnym znieczuleniu ogólnym, z ochroną przeciwbólową śród- i pooperacyjną.
d) Hodowla myszy o potencjalnie szkodliwym fenotypie – po wyprowadzaniu nowej linii zmodyfikowanych genetycznie myszy, wszystkie są poddawane obserwacji, aby sprawdzić, czy zmiany nie wpływają negatywnie na ich dobrostan.
e) Domięśniowa iniekcja (zastrzyk) – analogiczna do stosowanych u ludzi dróg podawania leków i szczepionek.
f) Sensomotoryczne testy behawioralne – jest to test stosowany do określenia ogólnego poziomu aktywności i nawyków eksploracyjnych w modelach zaburzeń ośrodkowego układu nerwowego u gryzoni. Zwierzę umieszcza się na arenie (okrągłe/kwadratowe pudełko) i pozwala mu się swobodnie poruszać przez 10 minut, podczas gdy nagrywa je kamera. Materiał filmowy jest następnie analizowany przez zautomatyzowany system śledzenia. Brane są pod uwagę następujące parametry: przebyta odległość, prędkość i czas spędzony we wcześniej zdefiniowanych strefach. Ten prosty test jest przydatny w ocenie wpływu zastosowanych terapii na ogólną aktywność.
Prowadzone badania
 mRNA (typ RNA który przenosi informacje genetyczne)
mRNA (typ RNA który przenosi informacje genetyczne)
1. Badanie stabilności i efektywności działania szczepionek mRNA w różnych tkankach. Wyniki pomogą projektować szczepionki celowane do wybranego narządu.
2. Opracowanie technologii zwiększenia stabilności i wydajności powielania syntetycznego mRNA wprowadzonego do komórki, w celu stworzenia nowych szczepionek przeciwnowotworowych i nowych rozwiązań immunoterapeutycznych.
3. Badanie wydajności dostarczania nanocząsteczek zawierających mRNA do różnych typów komórek: udoskonalenie technologii terapeutycznego mRNA w celu uzyskania przeciwnowotworowych szczepionek mRNA.
4. Zbadanie procesu uwalniania mRNA (zamkniętego w nanocząstkach lipidowych) z pęcherzyków endosomalnych (odpowiedzialnych za transport substancji ze środowiska do komórki) do cytoplazmy. Szacuje się, że zaledwie kilka do kilkunastu procent dostarczonego do komórki mRNA jest uwalniane do cytoplazmy. Poznanie tego procesu może pomóc w zwiększeniu wydajności działania terapeutycznych szczepionek mRNA.
5. Zbadanie jak organizm myszy metabolizuje leki oparte na mRNA, gdy w określonych tkankach brakuje konkretnych enzymów uczestniczących w niszczeniu badanych leków. Celem jest stworzenie podstaw do projektowania skutecznych terapii mRNA, które będą precyzyjnie trafiać do wybranych narządów.
Mutacje w genach powodujące choroby
1. Badanie skutków mutacji w genomie mitochondrialnym w różnych tkankach u myszy. W populacji ludzkiej, zaburzenia mitochondrialne dotykają 1 na 5000 osób, powodując poważne objawy ze strony układu nerwowego i mięśniowo-szkieletowego, dla których obecnie nie jest dostępne skuteczne leczenie.
2. Stworzenie linii myszy pozbawionych jednego z genów kodujących białko, którego inhibitor (substancja blokująca) może stać się nowym lekiem w leczeniu raka piersi.
3. Badanie nad skutecznością leczenia przeciwnowotworowego czerniaka – groźnego nowotworu złośliwego skóry, który co roku wykrywa się u około 110 000 pacjentów.
4. Badanie danio pręgowanego z mutacją genetyczną powodującą zachowania przypominające objawy spektrum autyzmu w obszarze interakcji społecznych, reakcji na nowe bodźce oraz aktywności genów odpowiedzialnych za prawidłowy rozwój mózgu.
Badanie mózgu (depresja)
1. Badanie mózgu zwierząt w celu sprawdzenia czy zaburzenie aktywności wybranych genów będzie prowadziło do takich samych zmian, jakie uzyskano w badaniach komórkowych. Sprawdzenie czy zmiany te będą wpływać na zachowanie zwierząt charakterystyczne dla depresji (np. zwiększenie poziomu bezradności) i osłabiać ich zdolność skutecznego myślenia (np. podczas nauki).
2. Testowanie na zwierzętach potencjału antydepresyjnego 21 substancji wytypowanych na podstawie określonej charakterystyki farmakologicznej. W przypadku pozytywnych efektów badań, zostanie podjęta współpraca z klinicystami w celu opracowania pilotażowego badania klinicznego. Poszukiwanie nowych leków antydepresyjnych jest konieczne, ponieważ obecnie dostępne terapie są skuteczne tylko w 50 proc., a wiele osób nie reaguje na kolejne próby leczenia (depresja lekooporna).
Badanie odpowiedzi układu odpornościowego
1. Analiza odpowiedzi układu odpornościowego (odporności wrodzonej) na zmodyfikowane cząsteczki RNA reprezentujące zarówno wirusowy RNA jak i RNA gospodarza (myszy). Wyniki tych badań pomogą zrozumieć jak najlepiej zapobiegać i leczyć poważne choroby wirusowe oraz autoimmunologiczne.
2. Badanie skutków zapalenia wywołanego endotoksyną bakteryjną (LPS) u myszy z niedoborem żelaza w celu zrozumienia rozwoju anemii podczas infekcji i chorób zapalnych.
Badanie interakcji między mikrobiotą jelitowa a wątrobą
1. Badanie wpływu bakterii żyjących w jelitach (mikrobioty) na rozwój zapalenia wątroby po spożyciu toksyny obecnej w muchomorze sromotnikowym. Badania obejmują również wpływ tej toksyny na komórki wątroby oraz możliwości zatrzymania postępu choroby.
2. Badanie, jak marskość wątroby wpływa na funkcjonowanie jelit, w celu znalezienia nowych sposobów leczenia tej choroby.
3. Analiza wzajemnych oddziaływań pomiędzy jelitami a wątrobą w przebiegu marskości wątroby. Celem badania jest wyjaśnienie roli mikrobioty w rozwoju choroby oraz zrozumienia jak uszkodzenia wątroby wpływają na skład i funkcjonowanie mikroorganizmów jelitowych.
Gospodarka żelaza
1. Badanie mechanizmów usuwania wolnej hemoglobiny z organizmu zarówno w warunkach fizjologicznych, jak i podczas hemolizy – procesu rozpadu czerwonych krwinek towarzyszącego wielu chorobom.
2. Analiza nowych mechanizmów regulujących recykling żelaza z erytrocytów u myszy z dietetycznym niedoborem żelaza. Deficyt tego pierwiastka jest globalnym problemem medycznym.
Tworzenie zwierzęcych modeli ludzkich chorób
Zmieniając określone geny zwierząt (wprowadzając mutacje) możemy wywołać u nich choroby obserwowane u ludzi. Tworzenie takich zwierzęcych modeli ludzkich chorób umożliwia lepsze poznanie mechanizmów tych schorzeń oraz opracowanie skuteczniejszych metod leczenia.
Danio pręgowany – wprowadzone mutacje:
- związane z chorobą Parkinsona,
- powodujące wrodzone wady serca wynikające z zaburzeń rozwoju tego narządu,
- prowadzące do nieprawidłowego rozwoju ucha wewnętrznego i zaburzeń słuchu.
Myszy – wprowadzone mutacje:
- powodujące następujące choroby:
- dystrofię mięśniową,
- zaburzenia metaboliczne o nieznanym podłożu,
- wady neurorozwojowe,
- spektrum autyzmu,
- białaczkę, - powodujące nietolerancję na jeden z leków stosowanych w leczeniu białaczki,
- zaburzające proces tworzenia naczyń krwionośnych.
Dowiedz się więcej - KLIKNIJ W LINK:
Badania naukowe z wykorzystaniem zwierząt laboratoryjnych
Znaczenie badań
Regulacje
Badania w MIBMiK
Regulacje - zasady prowadzenia badań
Zwierzęta laboratoryjne są wykorzystywane w badaniach wyłącznie wtedy, gdy nie jest możliwe zastosowanie innych metod i gdy uzasadnia to cel badania.
Regulacja prawne
 1. Prowadzenie badań na zwierzętach regulują europejskie i krajowe przepisy: Dyrektywa Parlamentu Europejskiego i Rady 2010/63/UE w sprawie ochrony zwierząt wykorzystywanych w celach naukowych, Ustawa z dnia 15 stycznia 2015 r. o ochronie zwierząt wykorzystywanych do celów naukowych lub edukacyjnych (Dz.U. 2015, poz. 266, z późniejszymi zmianami), Rozporządzenie Ministra Edukacji i Nauki z dnia 30 listopada 2022 r. w sprawie szkoleń, praktyk i staży dla osób wykonujących czynności związane z wykorzystywaniem zwierząt do celów naukowych lub edukacyjnych (Dz.U. 2022, poz. 2576).
1. Prowadzenie badań na zwierzętach regulują europejskie i krajowe przepisy: Dyrektywa Parlamentu Europejskiego i Rady 2010/63/UE w sprawie ochrony zwierząt wykorzystywanych w celach naukowych, Ustawa z dnia 15 stycznia 2015 r. o ochronie zwierząt wykorzystywanych do celów naukowych lub edukacyjnych (Dz.U. 2015, poz. 266, z późniejszymi zmianami), Rozporządzenie Ministra Edukacji i Nauki z dnia 30 listopada 2022 r. w sprawie szkoleń, praktyk i staży dla osób wykonujących czynności związane z wykorzystywaniem zwierząt do celów naukowych lub edukacyjnych (Dz.U. 2022, poz. 2576).
2. Każde badanie z użyciem procedur na zwierzętach musi uzyskać zgodę Lokalnej Komisji Etycznej do Spraw Doświadczeń na Zwierzętach (LKE).
3. Wnioskując o pozwolenie do LKE, konieczne jest przedstawienie m.in.:
a) celu, opisu doświadczenia i zastosowanych procedur oraz ich dotkliwości dla zwierząt;
b) uzasadnienia wyboru gatunku zwierzęcia oraz liczby zwierząt biorących udział w badaniu, która musi zostać określona statystycznie w taki sposób, aby przy użyciu jak najmniejszej liczby osobników zrealizować założone cele badawcze;
c) uzasadnienia zastosowania w planowanych badaniach zasady 3R;
d) streszczenia nietechnicznego, które jest elementem ogólnie dostępnej informacji publicznej o planowanych eksperymentach i losie zwierząt.
4. Wniosek składany do LKE jest wcześniej opiniowany i zatwierdzany przez Zespół do spraw dobrostanu zwierząt, działający w danej instytucji.
5. Aby wykorzystywać zwierzęta w badaniach laboratoryjnych, naukowcy muszą uzyskać tzw. wyznaczenie – dokument potwierdzający, że przeszli szkolenie teoretyczne i praktyczne oraz odpowiednie praktyki.
6. Zwierzętarnie podlegają zapowiedzianym i niezapowiedzianym kontrolom zewnętrznym, które przeprowadzane są przez Powiatowego Lekarza Weterynarii oraz kontrolom wewnętrznym przeprowadzanym przez Zespół ds. dobrostanu zwierząt.
Powołany w Instytucie Zespół ds. dobrostanu zwierząt kilka razy w roku przeprowadza kontrole wewnętrzne warunków hodowli zwierząt i ich kondycji oraz wybranych doświadczeń przeprowadzanych z udziałem zwierząt.
Zasada 3R
 Zasada 3R (Replacement, Reduction, Refinement) obejmuje wytyczne, którymi należy kierować się w czasie planowania i prowadzenia doświadczeń na zwierzętach. Ma ona na celu ograniczenie udziału zwierząt w badaniach laboratoryjnych i polepszanie ich dobrostanu.
Zasada 3R (Replacement, Reduction, Refinement) obejmuje wytyczne, którymi należy kierować się w czasie planowania i prowadzenia doświadczeń na zwierzętach. Ma ona na celu ograniczenie udziału zwierząt w badaniach laboratoryjnych i polepszanie ich dobrostanu.
Zasada 3R:
Zastąpienie (Replacement) – stosowanie alternatywnych metod badawczych w miejsce badań z wykorzystaniem zwierząt.
Ograniczenie (Reduction) – zmniejszenie liczby badanych zwierząt do niezbędnego minimum przy zachowaniu wiarygodności danych statystycznych.
Udoskonalanie (Refinement) – minimalizację stresu i cierpienia zwierząt poprzez optymalizację warunków ich środowiska oraz wykonywanie procedur z zastosowaniem najnowocześniejszych metod mających poprawić dobrostan zwierząt w eksperymencie.
Szkolimy z przeprowadzania badań z wykorzystaniem zwierząt laboratoryjnych
We współpracy z Polskim Towarzystwem Nauk o Zwierzętach Laboratoryjnych (PolLASA) prowadzimy szkolenie teoretyczne w języku angielskim dla obcokrajowców z różnych instytucji naukowych w kraju. Nasz kurs obejmuje obowiązkowy panel dotyczący pracy z danio pręgowanym, a także jego zarodkami. Użycie larw danio pręgowatego w doświadczeniach jest metodą alternatywną i realizuje zasadę zastąpienia. DOWIEDZ SIĘ WIĘCEJ
Dowiedz się więcej - KLIKNIJ W LINK:
Badania naukowe z wykorzystaniem zwierząt laboratoryjnych
Znaczenie badań
Regulacje
Badania w MIBMiK
Znaczenie badań z wykorzystaniem zwierząt
 Bez wykorzystania zwierząt laboratoryjnych, nie jesteśmy w stanie odpowiedzieć na część pytań naukowych i medycznych. Organizmy zwierząt laboratoryjnych pod wieloma względami są podobne do ludzkich: 99% genomu myszy laboratoryjnej i 70% genomu danio pręgowanego jest identyczne z genomem człowieka. Choć alternatywne metody badawcze dynamicznie się rozwijają, wciąż nie zastępują one w pełni metody in vivo (badań na modelach zwierzęcych).
Bez wykorzystania zwierząt laboratoryjnych, nie jesteśmy w stanie odpowiedzieć na część pytań naukowych i medycznych. Organizmy zwierząt laboratoryjnych pod wieloma względami są podobne do ludzkich: 99% genomu myszy laboratoryjnej i 70% genomu danio pręgowanego jest identyczne z genomem człowieka. Choć alternatywne metody badawcze dynamicznie się rozwijają, wciąż nie zastępują one w pełni metody in vivo (badań na modelach zwierzęcych).
Badania naukowe prowadzone z udziałem zwierząt laboratoryjnych pozwalają nam zrozumieć skomplikowane procesy zachodzące między różnymi typami komórek i tkanek, których nie jesteśmy w stanie obserwować w badaniach przy użyciu modeli komórkowych. Obecnie żadne ze sztucznie utworzonych systemów imitujących żywe organizmy, w tym te najnowocześniejsze jak organoidy, nie obejmują w pełni złożoności rozwoju i funkcjonowania żywego organizmu.
Wybrane wyniki badań naukowych z wykorzystaniem zwierząt, zrealizowane przez MIBMiK
Medycyna
1. Nasze badania opublikowane w czasopiśmie „Nature” wykazały, że enzym TENT5A odgrywa kluczową rolę w ochronie terapeutycznego mRNA przed degradacją w komórkach. Dzieje się tak dzięki wydłużeniu przez ten enzym ogonów poli(A), które są ochronnymi końcami cząsteczek mRNA. Odkryty mechanizm tłumaczy skuteczność działania szczepionek przeciwko COVID-19 i otwiera nowe możliwości projektowania bardziej efektywnych terapii mRNA (myszy, Krawczyk et al., 2025).
2. Opracowaliśmy innowacyjne narzędzie o nazwie Ninetails, wykorzystujące sztuczną inteligencję do precyzyjnej analizy końców cząsteczek mRNA. Odkryliśmy, że zakończenia mRNA są bardziej zróżnicowane, niż wcześniej sądzono, co ma kluczowe znaczenie dla stabilności i skuteczności działania leków opartych na mRNA, w tym szczepionek (myszy, Gumińska et al., 2025).
3. Wykazaliśmy, że syntetyczne RNA rozpoczynające się od specyficznego związku – adenozyny, wywołuje silniejszą reakcję układu odpornościowego u myszy, niż RNA zaczynające się od guanozyny. To odkrycie może przyczynić się do opracowania bezpieczniejszych i skuteczniejszych szczepionek RNA oraz innych terapii (myszy, Wolczyk et al., 2024).
4. Udowodniliśmy, że określone komórki wątroby reagują na nadmiar żelaza, uruchamiając mechanizm przywracający jego prawidłowy poziom w organizmie. To odkrycie może pomóc w leczeniu chorób związanych z zaburzoną gospodarką żelazem (myszy, Żurawska et al., 2024).
5. Dowiedliśmy, że jedną z pierwszych oznak starzenia się organizmu jest zaburzone odzyskiwanie żelaza z czerwonych krwinek, spowodowane przez osłabienie funkcji specjalnych komórek w śledzionie. Badania na myszach pokazały, że ten proces można spowolnić, ograniczając ilość żelaza w diecie (myszy, Slusarczyk et al., 2023).
6. Odkryliśmy, że szczepionki mRNA są stabilizowane przez białka obecne w komórkach, i tylko dzięki nim powstaje odporność na choroby (myszy, Krawczyk et al., 2023).
7. Znaleźliśmy przyczyny wrodzonej łamliwości kości u dzieci z mutacją w genie TENT5A (myszy, Gewartowska et al., 2021).
8. Odkryliśmy w jaki sposób mutacje w genie Tent5c przyczyniają się do rozwoju szpiczaka mnogiego (rodzaj nowotworu układu krwiotwórczego) i w jaki sposób Tent5c wpływa na działanie układu odpornościowego (myszy, Mroczek et al., 2017, Bilska et al., 2020)
9. Za pomocą techniki CRISPR-Cas9 opracowaliśmy linie danio pręgowanego z mutacjami w genach npc. Przyczyniło się do lepszego zrozumienia choroby Niemanna-Picka (powodującej uszkodzenia wielu narządów w organizmie) i może przyspieszyć rozwój terapii (danio pręgowany, Wiweger et al., 2021).
10. Poprzez badania nad mikroRNA-7 ujawniliśmy, jak mikroRNA wpływa na rozwój neuronalny, co potencjalnie może mieć zastosowania w terapiach chorób neurodegeneracyjnych, takich jak choroba Parkinsona (danio pręgowany, Adusumilli et al., 2020).
11. Poprzez badania nad rybami z niedoborem Tsc2, wykazaliśmy u nich hiperaktywność szlaku mTorC1 i nieprawidłowy rozwój połączeń między komórkami mózgu; te wyniki mogą być kluczowe dla rozwoju terapii symptomów neuropsychiatrycznych w przebiegu stwardnienia guzowatego (danio pregowany, Kedra et al., 2020 i Prentzell et al.,2021).
Biologia rozwoju
1. Udowodniliśmy, że aktywność białek z rodziny TENT5 jest niezbędna do prawidłowego powstania i rozwoju komórek rozrodczych – komórek jajowych i plemników. Lepsze zrozumienie tego procesu może wspierać diagnostykę i leczenie niepłodności (myszy, Brouze et al., 2024).
2. Dzięki zastosowaniu zintegrowanych narzędzi genomiki, poznaliśmy molekularne czynniki odpowiedzialne za wrodzone wady serca (danio pręgowany, Baranasic et al., 2022).
3. Poznaliśmy molekularne mechanizmy regeneracji serca u danio pręgowanego, co może przyczynić się do lepszego zrozumienia braku regeneracji serca u ludzi i sprofilowania terapii u pacjentów po zawale serca (danio pręgowany, Pawlak et al., 2019).
4. Odkryliśmy funkcję enzymów ADAR, które przekształcają adenozynę w inozynę, co ma kluczowe znaczenie dla prawidłowego rozwoju embrionalnego i odpowiedzi immunologicznej (danio pręgowany, Niescierowicz et al., 2022).
5. Stwierdziliśmy, że prawidłowy rozwój i działanie ucha wewnętrznego zależy od stężenia jonów potasu, z udziałem białka Kv2.1/KCNB1 (danio pregowany, Jedrychowska et al., 2021).
6. Badania białka Wnt3 dostarczyły nam wglądu w jego rozmieszczenie i funkcje w mózgu ryb, co jest istotne dla zrozumienia mechanizmów rozwojowych mózgu kręgowców (danio pręgowany, Veerapathiran et al., 2020).
Biologia komórki procesów starzenia
1. Odkryliśmy nowy mechanizm regulujący ruch lizosomów – pęcherzykowych struktur komórkowych odpowiedzialnych za usuwanie zbędnych elementów z komórek. Otrzymane wyniki mogą pomóc w zrozumieniu procesu starzenia się komórek oraz ich reakcji na stres (szczury, Tempes et al., 2024).
2. Wykazaliśmy, że białko STIM2 odgrywa ważną rolę w przetwarzaniu bodźców wzrokowych oraz w produkcji insuliny przez komórki nerwowe w mózgu. Brak tego białka może prowadzić do zmian w siatkówce przypominających jaskrę. Ta wiedza otwiera nowe możliwości badania związku między sygnałami wapniowymi, insuliną i funkcjonowaniem neuronów (danio pręgowany, Baranykova et al., 2024).
Dowiedz się więcej - KLIKNIJ W LINK:
Badania naukowe z wykorzystaniem zwierząt laboratoryjnych
Znaczenie badań
Regulacje
Badania w MIBMiK
Badania naukowe z wykorzystaniem zwierząt laboratoryjnych
W Międzynarodowym Instytucie Biologii Molekularnej i Komórkowej w Warszawie prowadzimy badania podstawowe (eksperymentalne i teoretyczne) oraz aplikacyjne na poziomie molekularnym, organelli, komórek, tkanek i całych organizmów. Naszym celem jest poszerzenie obecnej wiedzy i przyczynienie się do rozwoju terapii medycznych. Koncentrujemy się na chorobach neurologicznych i nowotworowych, chorobach rzadkich oraz rozwoju nowej generacji leków z wykorzystaniem technologii RNA.
Wachlarz technik i modeli badawczych jakich używamy w Instytucie jest szeroki: modelowanie komputerowe, eksperymenty biochemiczne na białkach wyprodukowanych przez bakterie, badania na liniach komórkowych, organoidach i niższych organizmach (nicieniach). Prowadzimy również badania naukowe z wykorzystaniem zwierząt laboratoryjnych: danio pręgowanego (ryba gatunku Dario rerio, ang. zebrafish), myszy i szczurów. Przy planowaniu i przeprowadzaniu badań z udziałem zwierząt kierujemy się unijnymi i krajowymi regulacjami oraz zasadą 3R (zastąpienie, ograniczenie, udoskonalenie).
Zwierzęta laboratoryjne są wykorzystywane w badaniach wyłącznie wtedy, gdy nie jest możliwe zastosowanie innych metod i gdy uzasadnia to cel badania.
 – Zależy nam na prowadzeniu badań w sposób odpowiedzialny, tj. wykorzystaniu zwierząt w badaniach naukowych wyłącznie wtedy, gdy nie można zastosować innych metod badawczych oraz na transparentnej komunikacji w tym obszarze – mówi Olga Gewartowska, kierowniczka Pracowni Inżynierii Genomu w MIBMiK i członkini Krajowej Komisji Etycznej do Spraw Doświadczeń na Zwierzętach.
– Zależy nam na prowadzeniu badań w sposób odpowiedzialny, tj. wykorzystaniu zwierząt w badaniach naukowych wyłącznie wtedy, gdy nie można zastosować innych metod badawczych oraz na transparentnej komunikacji w tym obszarze – mówi Olga Gewartowska, kierowniczka Pracowni Inżynierii Genomu w MIBMiK i członkini Krajowej Komisji Etycznej do Spraw Doświadczeń na Zwierzętach.
Kontakt:
Jeśli masz pytania, napisz do nas: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Dowiedz się więcej - KLIKNIJ W LINK:
Badania naukowe z wykorzystaniem zwierząt laboratoryjnych
Znaczenie badań
Regulacje
Badania w MIBMiK
|
IIMCB jest członkiem European Animal Research Association (EARA) – europejskiej organizacji wspierającej przejrzystość i komunikację na temat badań naukowych z wykorzystaniem zwierząt. Wśród wielu swoich inicjatyw EARA organizuje m.in. EARA Patient Day, wydarzenie łączące pacjentów, naukowców i lekarzy, mające na celu ukazanie znaczenia badań biomedycznych dla rozwoju terapii. Więcej informacji o EARA Patient Day można znaleźć tutaj: https://www.eara.eu/patient-discovery |
The P.I. of the Laboratory of Protein Metabolism at IIMCB in Warsaw, Dr. Wojciech Pokrzywa, accompanied by doctoral students Natalia and Anwesha, had the opportunity to travel to the University of Oslo to meet with their Norwegian partner, Prof. Rafal Ciosk, and his team. The primary objective of this visit was to assess the progress of their collaborative research funded by the GRIEG grant and to strategize for forthcoming research initiatives.

A fruitful grant meeting is behind us! An interesting discussion, exchange of ideas and plans for further research. Dziembowska lab from CeNT UW, Bramham lab from UiB and Dziembowski lab from IIMCB (+Radwańska lab from Nencki Institute) have a networking session in Wierzba PAN!


The aim of the meeting was to explore RNA Biology and to inspire scientific community to undertake new research directions in this rapidly growing field of life sciences. The program broadly aligned with the RNA Biology in prokaryotic and eukaryotic systems with topics focused on transcription, RNA processing and metabolism, non-coding RNAs, RNA in therapy and medicine.
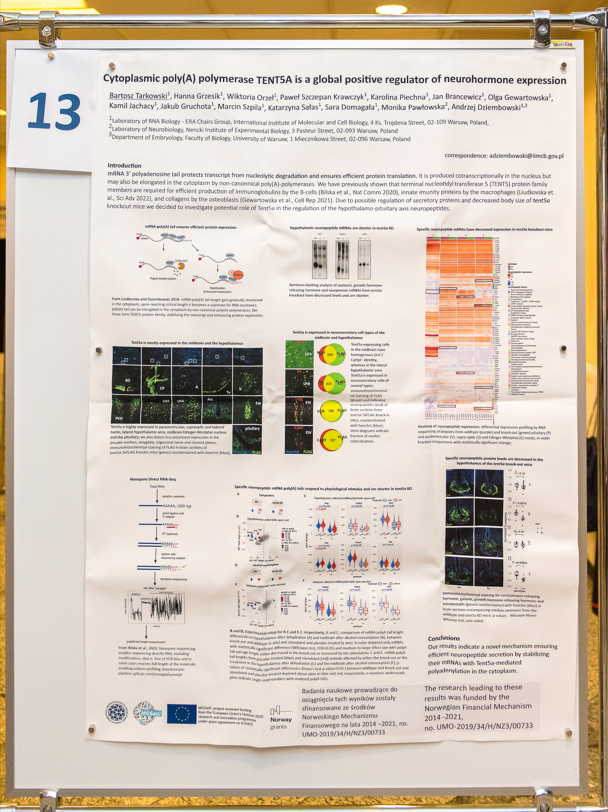
Paweł Krawczyk (member of GRIEGs project team) had a lecture druing on 28th September "SARS-CoV-2 mRNA vaccine is re-adenylated in vivo, enhancing antigen production and immune response". Also during the Poster Session there was a poster "Cytoplasmic poly(A) polymerase TENT5A is a global positive regulator of neurohormone expression" with project results.

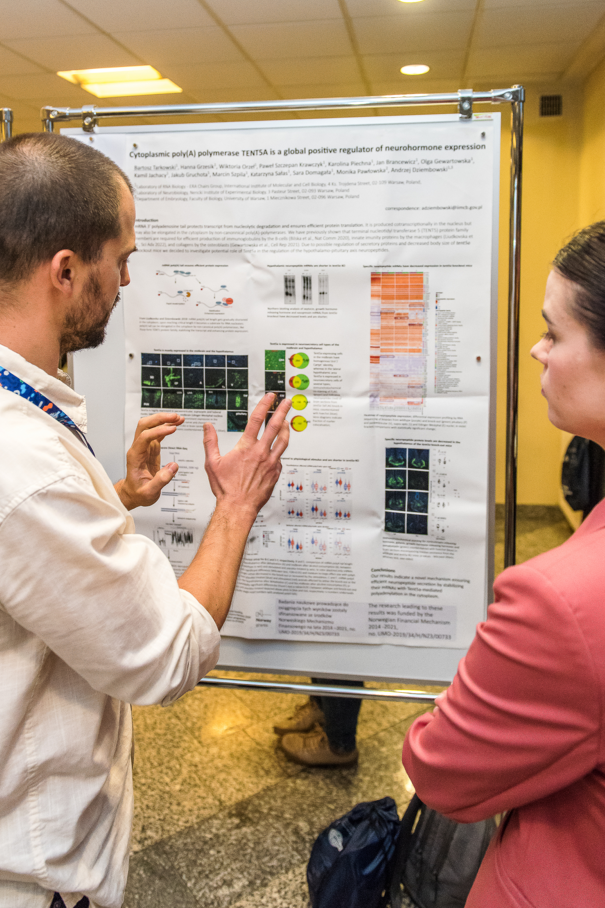
The conference was an occasion to gain new insights across a broad range of nanopore technology. It was the opportunity to get hands-on with the technology, hear the latest from the Oxford Nanopore team, and of course network with other members of the Nanopore Community. Ms. Gumińska took a role of the representative of GRIEG project being able to discuss the new prospects of Nanopore technology following the technology changes, further consequences of that operations. The given chance of being directly with the producent, asking questions regarding possible plans for the future, provided a bit more ability for any predictions, theories that could be implemented.
CONCEPT AND OBJECTIVES
Polish science, including biomedical research, has made huge advances in the last 30 years. However, the advancement of its fundamental scientific discoveries toward medical or commercial applications still lags behind the top countries, worldwide. This gap stems from the limited experience of Polish researchers in the field of translational research. The International Institute of Molecular and Cell Biology in Warsaw (IIMCB) aims to close this gap by building the capacity to translate basic knowledge into clinical innovations and by introducing an entrepreneurship culture in the scientific environment in Poland. Since its creation, the IIMCB has been a lighthouse of research and management excellence in Poland. Recognizing the Institute’s achievements and future potential, the Polish government awarded funding to build an expanded, modern IIMCB headquarters, which will increase our capacity to 20 research groups. The RACE project under the Teaming programme helps us achieve our goal of upgrading the IIMCB to a world-class translational research Centre of Excellence in RNA and Cell Biology. Together with our Advanced Partners we have identified five Specific Objectives that are key to achieve our goal:
- Expand IIMCB Research & Innovation (R&I) activities by recruiting new research groups and broadening collaborations;
- Train the next generation of IIMCB world-class researchers for academia and industry, aligning their expertise and skills to the best research centres across the European Research Area (ERA);
- Enhance IIMCB methodological capabilities through the development of modern core facilities (CFs), which will provide services to both academia and industry sectors;
- Facilitate the implementation of IIMCB discoveries by launching the IIMCB’s RACE Technology Incubator;
- Enhance overall IIMCB science management and administrative structure to fit new challenges.
Ultimately, the RACE project will make the IIMCB a reference model in translational research countrywide and elevate the Institute to the top tier of European research centres ready to engage in competitive EU and global biomedical research and innovation projects at the frontiers of science.
RACE Work Packages:
|
1. Establishment of new research groups
Objective: to reach critical mass in RNA and cell biology research by establishment of 6 new groups Main tasks:
|
||
|
2. Researcher training
Objective: to train IIMCB staff in conducting world-class biomedical research with translational potential Main tasks:
|
||
|
3. Development of IIMCB Core Facilities
Objective: to build modern and highly efficient core facilities with services for internal and external users Main tasks:
|
||
|
4. Implementation of a RACE Incubator at IIMCB
Objective: to establish comprehensive TT support to successfully commercialize the IIMCB discoveries Main tasks:
|
||
|
5. IIMCB science management upscale
Objective: to develop HR activities to attract and retain the best talent, as well as digitalise science management and administrative processes; professionalise the administration for the upscaled IIMCB Main tasks:
|
||
|
6. Dissemination and communication
Objective: Proper dissemination of the project’s results and communication about RACE and IIMCB Main tasks:
|
||
|
7. Project management
Objective: to coordinate and manage the project Main tasks:
|
Funded by the European Union. Views and opinions expressed are however those of the author(s) only and do not necessarily reflect those of the European Union or the European Research Executive Agency. Neither the European Union nor the granting authority can be held responsible for them.
CONTACT
Project management
e-mail: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Communication
e-mail: Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.
Follow us on social media
Funded by the European Union. Views and opinions expressed are however those of the author(s) only and do not necessarily reflect those of the European Union or the European Research Executive Agency. Neither the European Union nor the granting authority can be held responsible for them.








