- Żelazo jest niezbędnym pierwiastkiem dla wielu procesów biologicznych, w tym transportu tlenu, syntezy DNA i oddychania komórkowego. Utrzymanie jego homeostazy jest kluczowe, ponieważ zarówno niedobór, jak i nadmiar żelaza mogą prowadzić do poważnych problemów zdrowotnych. W Laboratorium Homeostazy Żelaza badamy mechanizmy regulujące metabolizm tego pierwiastka, koncentrując się na jego recyklingu z czerwonych krwinek, mechanizmach detekcji jego poziomu w organizmie oraz wpływie na funkcje odpornościowe i rozwój chorób.
Podsumowanie badań
Jednym z kluczowych obszarów naszych badań jest recykling żelaza z czerwonych krwinek (erytrocytów), który odbywa się głównie za pośrednictwem makrofagów czerwonej miazgi śledzionowej (RPM). Komórki te rozkładają starzejące się erytrocyty, uwalniając żelazo do krwiobiegu. Mimo że jest to podstawowe źródło żelaza w organizmie, wiedza na temat funkcjonowania komórek RPM oraz czynników wpływających na efektywność tego procesu jest wciąż ograniczona. Nasze najnowsze badania wykazały, że wraz z wiekiem recykling żelaza ulega upośledzeniu. Stwierdziliśmy, że związane z wiekiem odkładanie się żelaza w makrofagach RPM prowadzi do ich dysfunkcji i obumierania, co można ograniczyć poprzez dietetyczne restrykcje żelaza u myszy.
W innym projekcie analizujemy unikalne zmiany funkcjonalne i metaboliczne w komórkach RPM w odpowiedzi na niedobór żelaza, które pozwalają organizmowi adaptować się do ograniczonych zasobów tego pierwiastka. Równolegle badamy nowe mechanizmy detekcji poziomu żelaza w organizmie, szczególnie te zachodzące w wyspecjalizowanych komórkach śródbłonka wątroby – LSECs. Odkryliśmy nowy szlak sygnalizacyjny obejmujący kinazy MAP oraz czynnik transkrypcyjny ETS1, który ulega aktywacji w warunkach nadmiaru żelaza i zwiększa ekspresję dobrze znanego „sensora żelaza” – Bmp6. Ponadto nasze badania wskazują, że LSECs są głównymi komórkami odpowiedzialnymi za usuwanie wolnej hemoglobiny z krwiobiegu, co odgrywa istotną rolę w fizjologicznym recyklingu żelaza oraz detoksykacji hemoglobiny w warunkach hemolitycznych.
Wpływ naukowy
- Ujawnienie zaburzeń w recyklingu żelaza jako wczesnej cechy starzenia się.
- Odkrycie nowego szlaku sygnalizacyjnego zaangażowanego w detekcję żelaza przez śródbłonek wątroby.
- Zidentyfikowanie nieznanej wcześniej roli śródbłonka wątroby w usuwaniu wolnej hemoglobiny, zarówno w warunkach fizjologicznych, jak i hemolitycznych.
Plany badawcze
- Zbadanie powiązań między efektywnością recyklingu żelaza a funkcjami odpornościowymi śledziony.
- Pogłębienie wiedzy na temat różnorodnych ról śródbłonka wątroby w utrzymaniu homeostazy żelaza.
- Dalsza analiza adaptacji makrofagów śledzionowych do niedoboru żelaza w zdrowiu i chorobie.
Komentarz
„W naszych badaniach najbardziej ekscytujące jest uświadomienie sobie, że niektóre „dogmaty” mogą być tylko częściowo prawdziwe lub wręcz całkowicie błędne. To nie tylko podważa dotychczasowe przekonania, ale również otwiera drogę do odkrywania nowych zasad fizjologii ssaków, które wciąż nie są w pełni poznane” – mówi dr Katarzyna Mleczko-Sanecka.
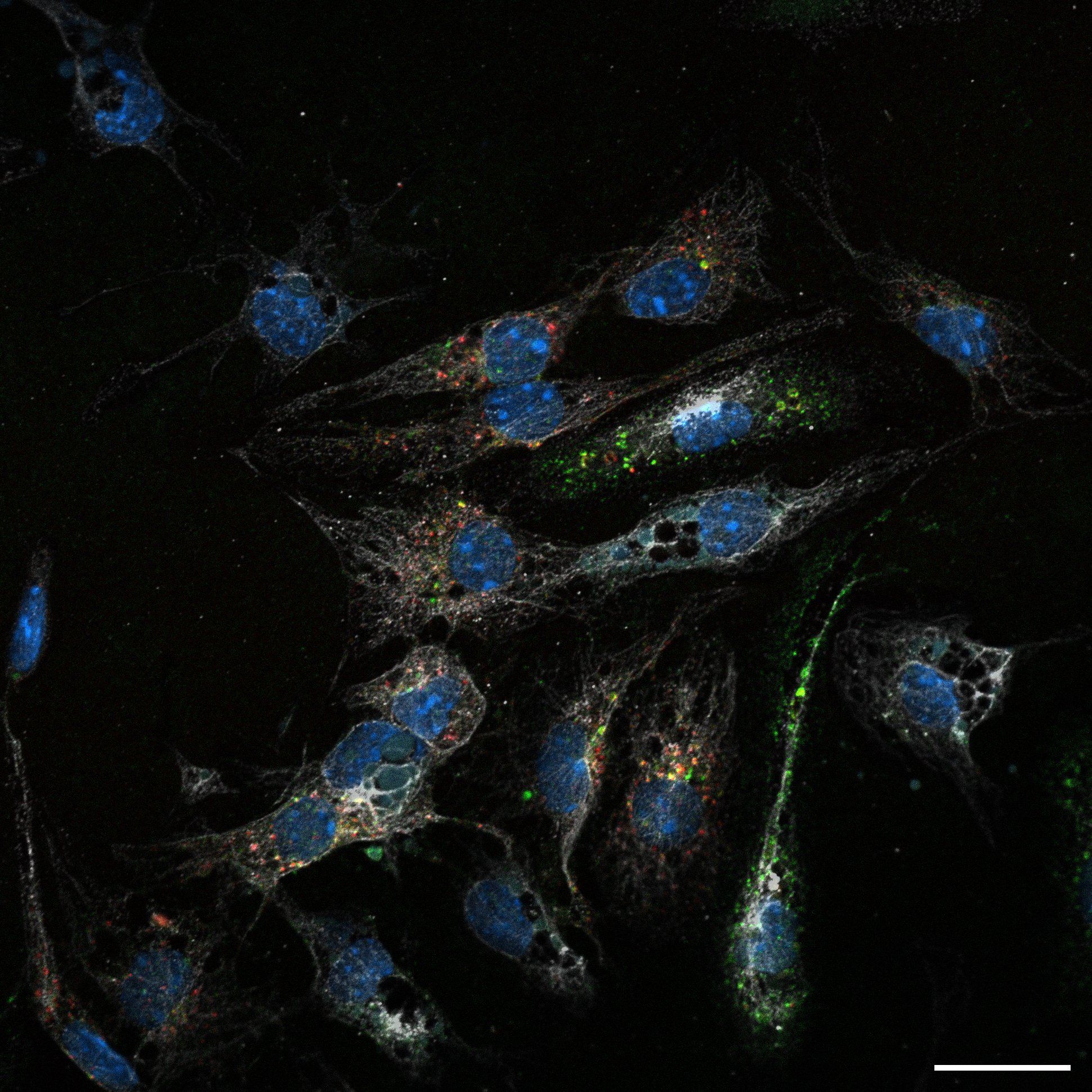
Pierwotne mysie komórki LSECs pobierające fluorescencyjnie znakowaną hemoglobinę. Ilustracja: Aneta Jończy.