Nasze laboratorium bada, w jaki sposób komórki utrzymują prawidłowy stan swojego proteomu – proces ten znany jest jako proteostaza. W szczególności interesuje nas przestrzenna i czasowa regulacja szlaków degradacji białek w komórkach ssaczych. Dążymy do zrozumienia, w jaki sposób zaburzenia tych systemów kontroli jakości przyczyniają się do rozwoju chorób neurodegeneracyjnych, takich jak choroba Alzheimera, Parkinsona czy Huntingtona.
Podsumowanie badań
Komórkowy proteom jest niezwykle złożony – składa się z tysięcy białek, które muszą być prawidłowo sfałdowane, zlokalizowane i usunięte, gdy są uszkodzone lub przestają być potrzebne. Równowaga ta – proteostaza – jest utrzymywana przez skoordynowane systemy kontrolujące syntezę, kontrolę jakości i degradację białek. Nasze laboratorium koncentruje się na mechanizmach odpowiedzialnych za usuwanie białek, w szczególności na układzie ubikwityna-proteasom (UPS), oraz na sposobach jego regulacji w różnych przedziałach komórkowych.
Celem naszych badań jest rozpracowanie molekularnych szlaków utrzymujących jakość białek w jądrze komórkowym oraz zrozumienie, jak te szlaki oddziałują z systemami degradacyjnymi obecnymi w cytoplazmie. Szczególnie interesuje nas transport nukleocytoplazmatyczny składników układu UPS, w tym unfoldazy VCP/p97. Zakłócona komunikacja między jądrowymi a cytoplazmatycznymi sieciami proteostazy może przyczyniać się do wczesnych etapów neurodegeneracji, lecz jej molekularne podstawy są wciąż słabo poznane.
Aby zbadać te mechanizmy, stosujemy połączenie nowoczesnych technik biologii molekularnej, wysokoprzepustowych badań przesiewowych opartych na CRISPR/Cas9, ilościowej spektrometrii mas oraz zaawansowanej mikroskopii fluorescencyjnej. Wykorzystujemy te narzędzia w komórkowych modelach chorób neurodegeneracyjnych, w tym w neuronach pochodzących z ludzkich indukowanych komórek pluripotencjalnych (iPSC) oraz w organoidach mózgowych. Naszym ostatecznym celem jest zidentyfikowanie mechanizmów, poprzez które sieci proteostazy zawodzą w chorobie, oraz odkrycie nowych strategii terapeutycznych, mających na celu przywrócenie równowagi białkowej w dotkniętych tkankach.
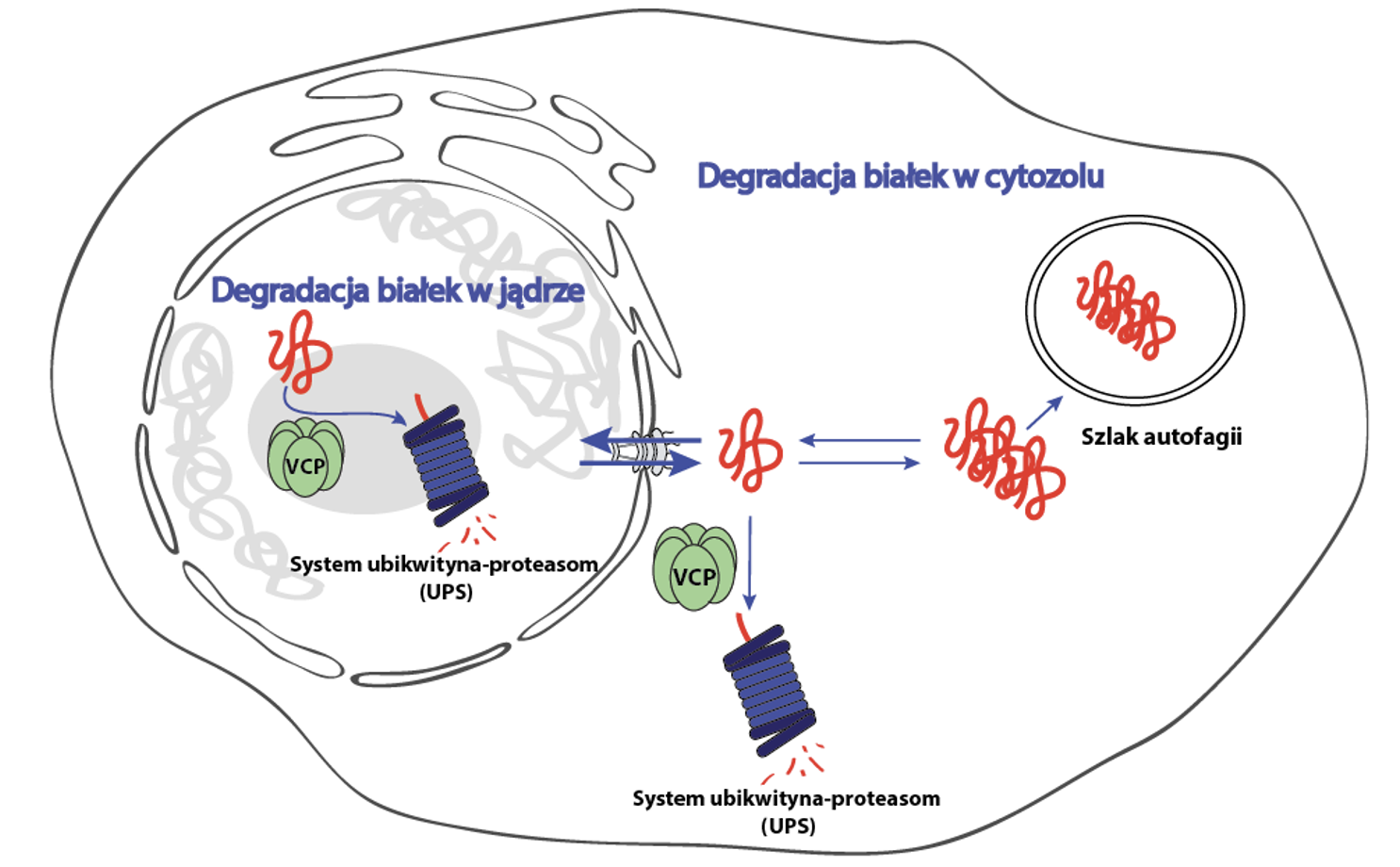
Fig.: Podstawowe szlaki degradacji białek w cytozolu i jądrze komórkowym
Wpływ naukowy
- - Identyfikacja mechanizmów regulujących proteostazę jądrową i ich powiązań z cytoplazmatycznymi szlakami degradacji
- - Nowe informacje na temat wpływu zaburzeń w szlakach usuwania białek na patologię chorób neurodegeneracyjnych
- - Opracowanie i zastosowanie ludzkich modeli neuronalnych do badania zaburzeń proteostazy związanych z chorobami
Plany badawcze
Naszym celem jest określenie, jak układ ubikwityna–proteasom funkcjonuje w jądrze komórkowym oraz w jaki sposób jądrowa proteostaza jest zintegrowana z ogólną kontrolą jakości białek w komórce. Będziemy również badać, jak zaburzenia tych systemów prowadzą do gromadzenia toksycznych agregatów białkowych – cechy charakterystycznej wielu chorób neurodegeneracyjnych. Ostatecznie mamy nadzieję zidentyfikować nowe molekularne cele terapeutyczne umożliwiające przywrócenie proteostazy w chorobowo zmienionych tkankach.
Współprace
Aktywnie poszukujemy interdyscyplinarnych form współpracy, łączących badania nad proteostazą molekularną z neurobiologią translacyjną. Współpracujemy z ekspertami w dziedzinie neurobiologii, obrazowania komórkowego, proteomiki oraz medycyny regeneracyjnej. Wspólne wysiłki koncentrują się na odkrywaniu celów terapeutycznych i walidacji wyników w istotnych modelach ludzkich chorób.
Komentarz
„Naszym celem jest zrozumienie, jak komórki regulują jakość i usuwanie białek, szczególnie w układzie nerwowym. Rozszyfrowanie molekularnych przyczyn niewydolności systemów proteostazy w neuronach może otworzyć nowe ścieżki terapeutyczne dla obecnie nieuleczalnych chorób neurodegeneracyjnych” – mówi dr Lidia Wróbel, kierownik Pracowni Proteostazy Komórkowej.




